题目内容
根据元素在周期表中的位置,判断下列各组化合物的水溶液的酸、碱性的强弱.
(1)H3PO4和HNO3 酸性
(2)KOH和Mg(OH)2 碱性
(3)Al(OH)3和Ca(OH)2 碱性 .
(1)H3PO4和HNO3 酸性
(2)KOH和Mg(OH)2 碱性
(3)Al(OH)3和Ca(OH)2 碱性
考点:金属在元素周期表中的位置及其性质递变的规律,非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:同一主族元素从上到下元素的非金属性逐渐减弱,金属性逐渐增强,非金属性越强,则对应的最高价氧化物的水合物的酸性越强;
同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱;同一主族元素从上到下元素的金属性逐渐增强,金属性越强,则对应的最高价氧化物的水合物的碱性越强.
同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱;同一主族元素从上到下元素的金属性逐渐增强,金属性越强,则对应的最高价氧化物的水合物的碱性越强.
解答:
解:(1)N和P在同一主族,P在N元素的下一周期,同一主族元素从上到下元素的非金属性逐渐减弱,则非金属性N>P,非金属性越强,则对应的最高价氧化物的水合物的酸性越强,所以:酸性H3PO4<HNO3,故答案为:H3PO4<HNO3;
(2)K位于第四周期第ⅠA族,Mg位于第三周期第ⅡA族,同一主族元素从上到下元素的金属性逐渐增强,同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱,则金属性K>Mg,所以碱性KOH>Mg(OH)2,故答案为:KOH>Mg(OH)2;
(3)Ca位于第四周期第IIA族,Al位于第三周期IIIA族,同一主族元素从上到下元素的金属性逐渐增强,同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱,则金属性Ca>Al,所以碱性Al(OH)3<Ca(OH)2,故答案为:Al(OH)3<Ca(OH)2.
(2)K位于第四周期第ⅠA族,Mg位于第三周期第ⅡA族,同一主族元素从上到下元素的金属性逐渐增强,同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱,则金属性K>Mg,所以碱性KOH>Mg(OH)2,故答案为:KOH>Mg(OH)2;
(3)Ca位于第四周期第IIA族,Al位于第三周期IIIA族,同一主族元素从上到下元素的金属性逐渐增强,同一周期元素从左到右元素的金属性逐渐减弱,金属性越弱,则对应的最高价氧化物的水合物的碱性越弱,则金属性Ca>Al,所以碱性Al(OH)3<Ca(OH)2,故答案为:Al(OH)3<Ca(OH)2.
点评:本题考查金属性和非金属性的递变规律,注意元素周期律的递变规律,以及对应最高价氧化物对应水化物的酸性和碱性的比较,题目比较基础.

练习册系列答案
相关题目
一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+2B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,不能做为判断该化学平衡标志的是( )
| A、容器内气体A的物质的量不再随时间而改变 |
| B、容器内气体C的浓度不再随时间而改变 |
| C、单位时间内生成amol物质A,同时生成3amol物质B |
| D、单位时间内生成amol物质A,同时生成2amol物质C |
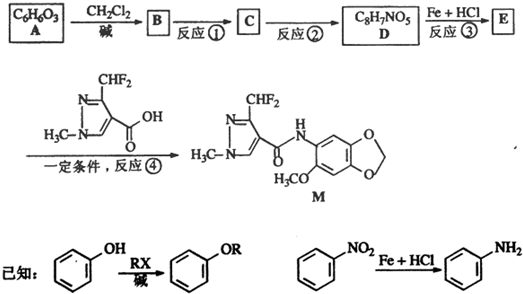
 如图所示,组成一个原电池.
如图所示,组成一个原电池.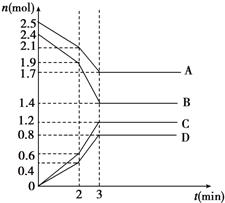 在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题:
在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题: