题目内容
18.某一烃分子中有一个由C-C键构成的六元环,有一个C=C键,还有一个C≡C键,则能满足上述条件的烃的分子式可能是( )| A. | C8H12 | B. | C10H16 | C. | C12H22 | D. | C14H22 |
分析 碳环的不饱和度是1,碳碳双键是1,碳碳三键的不饱和度为2,所以某烃的结构式中有一个由碳碳单键构成的六元环、含有一个碳碳双键和一个碳碳三键,它的不饱和度为4,以此来解答.
解答 解:六元碳环的不饱和度是1,碳碳双键的不饱和度是1,碳碳三键的不饱和度为2,所以某烃的结构式中含有一个由碳碳单键构成的六元环,一个碳碳双键和一个碳碳三键它的不饱和度为4,
A.含有由C-C键构成的六元环,还含有1个C=C键、1个C≡C键,则该烃分子中至少含有10个C,故A错误;
B.C10H16的不饱和度为3,故B错误;
C.C12H22的不饱和度为2,故C错误;
D.C14H22的不饱和度为4,故D正确;
故选D.
点评 本题考查有机化合物中碳的成键特征和不饱和度的概念及应用,题目难度不大,明确六元碳环的不饱和度是1,碳碳双键的不饱和度是1,碳碳三键的不饱和度为2是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.橙花醛是一种香料,结构简式为:(CH3)2C=CHCH2CH2C(CH3)=CHCHO.下列说法正确的是( )
| A. | 橙花醛不可以与溴发生加成反应 | |
| B. | 1mol橙花醛最多可以与2mol氢气发生加成反应 | |
| C. | 橙花醛可以发生银镜反应,分子结构存在顺反异构 | |
| D. | 橙花醛是乙醛的同系物 |
13.下列关于同系物的叙述中不正确的是( )
| A. | 某有机物同系物组成可用通式CnH2n+2表示 | |
| B. | 同系物互为同分异构体 | |
| C. | 两个同系物之间相对分子质量相差14或14的整数倍 | |
| D. | 同系物具有相似的化学性质 |
10.下列化学反应属于吸热反应的是( )
| A. | NH4Cl与Ba(OH)2•8H2O研磨 | B. | 生石灰溶于水 | ||
| C. | 镁与稀盐酸反应 | D. | 甲烷燃烧 |
7.决定化学反应速率的主要因素是( )
| A. | 反应物的性质 | B. | 反应温度 | C. | 催化剂 | D. | 反应物的浓度 |
8.A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其相关信息如下:
请回答下列问题:
(1)F位于元素周期表第IB族,其简化电子排布式为[Ar]3d104s1 .
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为: ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.
(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.

(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物的性质相似,如Li和Mg,试写出向BeCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 原子核外电子有4种不同的运动状态 |
| C | 元素原子的核外成对电子数是未成对电子数的2倍且有3个能级 |
| D | 元素原子的核外p电子数比s电子数少1 |
| E | E原子的第一至第四电离能如下:I1=738 kJ•mol-1 I2=1451 kJ•mol-1 I3=7733 kJ•mol-1 I4=10540 kJ•mol-1 |
| F | 第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满 |
(1)F位于元素周期表第IB族,其简化电子排布式为[Ar]3d104s1 .
(2)D元素基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈哑铃形.
(3)某同学根据上述信息,推断E基态原子的核外电子排布图为:
 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.(4)A与D形成的D2A4分子中D原子的杂化类型为sp3杂化,A与D形成的最简单分子易溶于水的原因氨气分子能与水分子形成氢键.
(5)C的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1).则1个这种单质分子中所含π键的数目为30.

(6)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物的性质相似,如Li和Mg,试写出向BeCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
(7)图2是金属Ca和F所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力.已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=5(填数值);氢在合金中的密度为0.083g•cm-3.
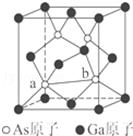 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.请回答下列问题:
 ⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.
⑦CH3CH2OH中与甲烷互为同系物的是①,分子空间构型为平面形的是④⑥,直线形的是⑤.