题目内容
下列说法正确的是( )
| A、C、N、O的第一电离能依次增大 |
| B、NH3、H3O+、NH4+均含有配位键 |
| C、P4、CCl4、CH4均为正四面体结构,键角均为109°28′ |
| D、HClO、HClO3、HClO4的酸性依次增强 |
考点:元素周期律的作用,键能、键长、键角及其应用,判断简单分子或离子的构型,配合物的成键情况
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族;
B、在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键;
C、P4结构为 ,为正四面体结构,键与键之间夹角为60°;
,为正四面体结构,键与键之间夹角为60°;
D、含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强;
B、在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键;
C、P4结构为
 ,为正四面体结构,键与键之间夹角为60°;
,为正四面体结构,键与键之间夹角为60°;D、含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强;
解答:
解:A、同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,由于氮原子是半满结构更稳定,所以其第一电离能大小顺序是:N>O>C,故A错误;
B、氨气分子中氮原子含有孤电子对,但氢原子不含空轨道;H3O+中氢离子提供空轨道,氧原子提供孤电子对,形成配位键;②NH4+氢离子提供空轨道,氮原子提供孤电子对,形成配位键,故B错误;
C、P4结构为 ,为正四面体结构,但键与键之间夹角为60°;CCl4、CH4均为正四面体结构
,为正四面体结构,但键与键之间夹角为60°;CCl4、CH4均为正四面体结构 ,但键角均为109°28′,故C错误;
,但键角均为109°28′,故C错误;
D、含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,酸性由强到弱:HClO4>HClO3>HClO,故D正确;
故选D.
B、氨气分子中氮原子含有孤电子对,但氢原子不含空轨道;H3O+中氢离子提供空轨道,氧原子提供孤电子对,形成配位键;②NH4+氢离子提供空轨道,氮原子提供孤电子对,形成配位键,故B错误;
C、P4结构为
 ,为正四面体结构,但键与键之间夹角为60°;CCl4、CH4均为正四面体结构
,为正四面体结构,但键与键之间夹角为60°;CCl4、CH4均为正四面体结构 ,但键角均为109°28′,故C错误;
,但键角均为109°28′,故C错误;D、含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,酸性由强到弱:HClO4>HClO3>HClO,故D正确;
故选D.
点评:本题考查第一电离能、配位键、含氧酸的酸性、键角等,题目难度中等,注意解答问题的方法的积累.

练习册系列答案
相关题目
在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如表.据此判断下列结论正确的是( )
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol?L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol?L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol?L-1) | 1 | 2.5 | 3 | 3 |
| A、在t3时刻反应已经停止 |
| B、A的转化率比B的转化率低 |
| C、该温度下此可逆反应平衡常数K=4 |
| D、该反应的化学方程式为2A(g)+B(g)?C(g) |
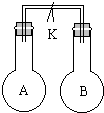 如图所示,室温下,两个容积相等的烧瓶中分别集满了A和B两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
如图所示,室温下,两个容积相等的烧瓶中分别集满了A和B两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )| 编号 | ① | ② | ③ | ④ |
| A中气体 | H2S | H2 | NH3 | NO |
| B中气体 | SO2 | O2 | HCl | O2 |
| A、②③④① | B、③①④② |
| C、③②①④ | D、④③②① |
 如图是Zn和Cu形成的原电池,则下列结论中正确的是( )
如图是Zn和Cu形成的原电池,则下列结论中正确的是( )①铜为阳极,锌为阴极;②铜极上有气泡;③SO
2- 4 |
| A、①②③ | B、②④⑥ |
| C、②③⑥ | D、③④⑤ |
可逆反应A(g)+3B(g)?2C(g);△H=-QkJ/mol.有甲、乙两个容积相同且固定不变的密闭容器,向甲容器中加入1mol A和3mol B,在一定条件下达到平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2mol C达到平衡后吸收热量为Q2 kJ,已知Q1=2Q2.下列叙述正确的是( )
| A、甲中A的转化率为75% | ||||
| B、Q1+Q2<Q | ||||
C、达到平衡后,再向乙中加入
| ||||
| D、乙中热化学方程式为2C(g)?A(g)+3B(g);△H=+Q2 kJ/mol |
下列关于乙烯的说法中,正确的是( )
| A、是无色气体,比空气略重,难溶于水 |
| B、与溴水发生取代反应而使溴水褪色 |
| C、可用于制造塑料,合成纤维,有机溶剂等 |
| D、在空气中点燃,火焰呈淡蓝色 |
一个氖原子的质量是a g,一个12C原子的质量为b g,NA表示阿伏德罗常数,下列说法不正确的是( )
A、该氖原子的相对原子质量是
| ||
| B、氖原子的摩尔质量为a?NA g/mol | ||
C、Wg该氖原子的物质的量为
| ||
D、Wg该氖原子所含原子数为
|