题目内容
16.将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,在不同温度下进行反应,得到如下表中的两组数据,下列说法不正确的是 ( )| 实验 编号 | 温度 /℃ | 平衡常数 /mol•L | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | X | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6 | B. | T1、T2的关系:T1>T2 | ||
| C. | K1、K2的关系:K2>K1 | D. | t<6 |
分析 分析图表数据,依据化学平衡三段式列式,结合反应速率概念计算;依据图表数据列式计算分析,反应是放热反应,化学平衡随温度升高,平衡逆向进行分析两次实验的温度.
解答 解:A、实验1从开始到反应达到化学平衡时,
2SO2(g)+O2(g) $?_{△}^{催化剂}$2SO3(g);
起始量(mol) 4 2 0
变化量(mol) 2.4 1.2 2.4
平衡量(mol) x 0.8 2.4
x=4-2.4=1.6,故A正确;
B、根据题中数据可知,实验1和实验2起始量相同,实验2达到平衡时间短,所以实验2的温度高,即T2>T1,故B错误;
C、该反应为放热反应,升高温度平衡逆向移动,由于T2>T1,所以K2<K1,故C错误;
D、温度越高反应速率越快,由于T2>T1,所以实验2达到平衡的时间小于实验1,即t<6,故D正确,
故选BC.
点评 本题考查了化学平衡影响因素和平衡计算的分析判断,注意知识的迁移和应用是解题关键,难度不大.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| B. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| C. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L.反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| D. |  某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ |
4.下列变化属于还原反应的是( )
| A. | Fe→FeSO4 | B. | AgNO3→Ag | C. | S→SO2 | D. | CO32-→CO2 |
11.两烧杯中分别盛有100mL3mol/L的硫酸溶液或100mL3mol/L的氢氧化钠溶液(先后顺序不确定),向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为3:4,下列说法正确的是( )
| A. | 参加反应的H2SO4为0.2mol | B. | 参加反应的NaOH约为0.27mol | ||
| C. | 加入铝粉的质量为5.4g | D. | 与硫酸反应的铝粉的质量7.2g |
1.下列各组物质中,分子数相同的是( )
| A. | 标准状况下,0.25 molO2和5.6 LH2O | |
| B. | 0.2 mol CO2和4.48 L CO | |
| C. | 11.2 LHCl和标准状况下0.5molH2 | |
| D. | 9 g水和标准状况下11.2 L NH3 |
8. 某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )
某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )
 某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )
某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
6.下列各组中的物质,互为同系物的是( )
| A. | 乙醇与丙三醇 | B. | C6H5OH与C6H5CH2OH | ||
| C. | 重氢与超重氢 | D. | 新戊烷与正丁烷 |
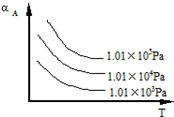 在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示:
在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示: