题目内容
9.下列叙述正确的是( )| A. | 开发核能、风能和太阳能等新能源,都可降低碳排放 | |
| B. | 自2011年5月1日起面粉中禁止添加CaO2等增白剂,CaO2属于碱性氧化物 | |
| C. | 厨房发生煤气泄漏时,应立即打开换气扇,并打开门窗通风 | |
| D. | 使用四乙基铅作汽油抗震剂,可减少汽车尾气的污染 |
分析 A.核能、风能和太阳能不含碳,可减少二氧化碳的排放;
B.过氧化物不属于碱性氧化物;
C.厨房发生煤气泄漏时不能通电,防止发生爆炸;
D.铅能使人体中毒.
解答 解:A.开发核能、风能和太阳能等新能源,可以减少化石燃料的使用,都可降低碳排放,故A正确;
B.CaO2属于过氧化物,过氧化物不属于碱性氧化物,CaO2不属于碱性氧化物,故B错误;
C.电流接通的一刹那会产生电火花,这种电火花虽然很小,我们甚至看不到,但温度却不低,一旦瞬间点燃泄漏的燃气,就会引发爆炸爆炸,故C错误;
D.使用四乙基铅作汽油抗震剂,在汽车尾气中会含有铅元素,会加重空气污染,故D错误.
故选A.
点评 本题考查了化学与社会、科学、生活、环境等问题,难度不大,是高考化学试题的热点问题,这一考点往往为常识性的知识与运用化学原理解决实际问题,应予以重视.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
19.分别加入适量下列物质,能使湿润的淀粉-KI试纸变蓝的是( )
| A. | NaCl | B. | Fe粉 | C. | 盐酸 | D. | 氯气 |
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 100 mL 0.1 mol•L-1 K2SO4溶液中,含有氧原子数为0.04NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| C. | 25℃时,1.0 L pH=13的Ba(OH)2溶液中,含有的OH-数目为0.2NA | |
| D. | 100 g 17%的氨水中,含有氨分子数为NA |
4.下列化学用语正确的是( )
| A. | 氯分子的电子式:Cl:Cl | B. | 氯离子的电子式:Cl- | ||
| C. | 氯离子的结构示意图: | D. | 质量数为37的氯原子:1737Cl |
14.下列有关化学用语表达不正确的是( )
| A. | CO2的电子式: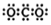 | |
| B. | CS2分子的结构式:S=C=S | |
| C. | S2-的结构示意图: | |
| D. | 8个中子的碳原子的核素符号:${\;}_6^{14}C$ |
1.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| C. | 1-丁烯(CH3CH2CH═CH2)与HCl分子发生的加成反应 | |
| D. | 苯甲酸( )与NaHCO3溶液反应 )与NaHCO3溶液反应 |
18.我国是干电池的生产和消费大国.某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质.电池总反应为
2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式MnO2+H2O+e-=MnOOH+OH-;
(2)为了提高碳包的浸出效率,可以采取的措施有适当的升温或搅拌;(写一条即可)
(3)向滤液1中加入MnS的目的是将溶液中的Zn2+离子转化为ZnS沉淀而除去;
(4)已知MnSO4的溶解度曲线如图1所示,从滤液2中析出MnSO4•H2O晶体的操作是蒸发结晶、趁热过滤、洗涤、低温干燥;
(5)为了选择试剂X,在相同条件下,分别用3g碳包进行制备MnSO4的实验,得到数据如表,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑.
(6)工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是碳酸钠溶液碱性强,容易产生Mn(OH)2沉淀;
(7)该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY.实验过程如下:准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500mol•L-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为25.2%.(保留3位有效数字)

已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质.电池总反应为
2MnO2+Zn+2KOH=2MnOOH+K2ZnO2,请写出电池的正极反应式MnO2+H2O+e-=MnOOH+OH-;
(2)为了提高碳包的浸出效率,可以采取的措施有适当的升温或搅拌;(写一条即可)
(3)向滤液1中加入MnS的目的是将溶液中的Zn2+离子转化为ZnS沉淀而除去;
(4)已知MnSO4的溶解度曲线如图1所示,从滤液2中析出MnSO4•H2O晶体的操作是蒸发结晶、趁热过滤、洗涤、低温干燥;
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.4 |
| 2 | 铁粉 | 2.7 |
| 3 | FeS粉末 | 3.0 |
| 4 | 30%过氧化氢 | 3.7 |
(6)工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是碳酸钠溶液碱性强,容易产生Mn(OH)2沉淀;
(7)该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY.实验过程如下:准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500mol•L-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为25.2%.(保留3位有效数字)
19.下列各组物质中,化学键类型相同,晶体类型也相同的是( )
| A. | C(金刚石)和CO2 | B. | NaBr和HBr | C. | Cl2和KCl. | D. | CH4和H2O? |
 乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.
乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料.