题目内容
3.已知分解1mol H2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:H2O2+I-→H2O+IO-慢 ①
H2O2+IO-→H2O+O2+I-快 ②
下列有关该反应的说法不正确的是( )
| A. | I-是该反应的催化剂,它可增加该反应的活化分子百分数 | |
| B. | H2O2分解的反应快慢主要由反应①决定的 | |
| C. | 反应速率与I-的浓度有关 | |
| D. | 2v(H2O2)=2v(H2O)=v(O2) |
分析 由反应机理可知I-为反应的催化剂,IO-为中间产物,第一步反应较慢,则决定过氧化氢的分解速率,因反应放热,则反应物总能量大小生成物总能量,以此解答该题.
解答 解:A.由两步反应可知,I-为反应的催化剂,可加快反应的速率,故A正确;
B.第一步反应较慢,则决定过氧化氢的分解速率,故B正确;
C.已知:①H2O2+I-→H2O+IO-,②H2O2+IO-→H2O+O2+I-,I-是反应的催化剂,且为①的反应物之一,其浓度大小对反应有影响,故C正确;
D.因为反应是在含少量I-的溶液中进行的,溶液中水的浓度是常数,不能用其浓度变化表示反应速率,故D错误.
故选D.
点评 本题考查化学反应与能量变化,侧重于学生的分析能力的考查,主要把握反应的特点,为解答该题的关键,难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
6.某种医药中间体X,其结构简式如图.下列有关该化合物说法正确的是( )
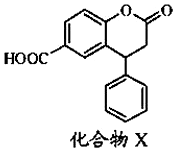

| A. | X的分子式为C15H10O4 | |
| B. | 分子中有3种含氧官能团 | |
| C. | X分子中3个六元环可能处于同一平面 | |
| D. | 即能发生酯化反应,又能发生水解反应 |
14.下面列出了电解不同物质的电极反应式,其中错误的是( )
| A. | 以惰性电极电解饱和食盐水阴极:Na++e-═Na | |
| B. | 用铜电极电解CuSO4溶液)阳极:Cu═Cu2++2e- | |
| C. | 以惰性电极电解熔融NaCl阴极:Na++e-═Na | |
| D. | 以惰性电极电解NaOH溶液阳极:4OH-═2H2O+O2↑+4e- |
11.下列各物质的分类、(名称或俗名)、化学式都正确的是( )
| A. | 金属氧化物 氧化铁 FeO | B. | 酸性氧化物 二氧化硫 SO2 | ||
| C. | 酸 硫酸 H2SO4 | D. | 碱 纯碱 Na2CO3 |
18.下列物质的转化在给定条件下能实现的是( )
| A. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{盐酸}{→}$H2SiO3 | |
| D. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{点解}{→}$Mg |
15.X、Y、Z三种元素都是短周期的主族元素.X是同周期主族元素中原子半径最大的元素;Y元素的原子的最外层电子数是其所在周期数的二倍;Z元素原子的最外层电子数是其所在周期数的三倍.下列有关叙述中正确的是( )
| A. | 用惰性电极电解由X、Y、Z形成的化合物的水溶液,电解后溶液的pH值一定增大 | |
| B. | 由X、Y、Z形成的化合物的分子式一定为X2YZ3 | |
| C. | 由X、Y、Z形成的化合物的水溶液可能呈酸性、中性或碱性 | |
| D. | X元素形成的单质晶体可能为金属晶体,Y、Z两元素形成的单质晶体一定为分子晶体 |
12.海洋中有丰富的食品、矿产、能源、药物和水产等资源,如图表示海水综合利用的部分过程.下列说法不正确的是( )
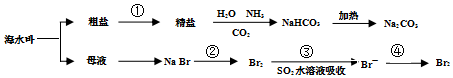

| A. | 工业上通过电解熔融状态MgCl2制取金属镁 | |
| B. | 用澄清石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第②、④步骤中,溴元素均被氧化 | |
| D. | 制取NaHCO3的反应中,利用了其溶解度在相同条件下小于NaCl的性质 |