题目内容
19.下列电解质在水中发生电离后得到的阴离子与阳离子的物质的量之比为2:1的是( )| A. | 氯化钡 | B. | 硫酸铜 | C. | 硝酸钾 | D. | 氯酸钾 |
分析 A、BaCl2是强酸强碱盐,在溶液中电离为Ba2+和Cl-;
B、CuSO4是强酸弱碱盐,在溶液中电离为Cu2+和SO42-;
C、KNO3能电离为K+和NO3-;
D、KClO3能电离为K+和ClO3-.
解答 解:A、BaCl2是强酸强碱盐,在溶液中电离为Ba2+和2个Cl-,且在溶液中均不水解,故阴离子与阳离子的物质的量之比为2:1,故A正确;
B、CuSO4是强酸弱碱盐,在溶液中电离为Cu2+和SO42-,由于Cu2+是弱碱阳离子,在溶液中会水解,故溶液中阴离子与阳离子的物质的量之比大于1:1,故B错误;
C、KNO3能电离为K+和NO3-,且均不水解,故阴离子与阳离子的物质的量之比1:1,故C错误;
D、KClO3能电离为K+和ClO3-,且均不水解,故阴离子与阳离子的物质的量之比1:1,故D错误;
故选A.
点评 本题考查了电解质在水溶液中的电离,应注意盐类的水解对离子个数的影响,难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
10.工业上制取漂白粉的最初原料一般是( )
| A. | NaCl、CaCO3 | B. | CaCO3、Cl2 | C. | Cl2、Ca(OH)2 | D. | Ca(OH)2、NaCl |
7.下列各表述与示意图一致的是( )
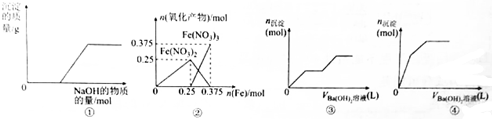

| A. | 图①表示向Ca(HCO3)2溶液中滴加NaOH溶液时,产生沉淀的质量与加入NaOH的物质的量之间的关系 | |
| B. | 图②表示向n(HNO3)=1mol的稀HNO3中加入Fe时,氧化产物(还原产物为NO)的物质的量与Fe的物质的量之间的关系 | |
| C. | 图③可用来表示向含有4mol HCl和1mol MgSO4的混合溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 | |
| D. | 图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系 |
4.已知①Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓②Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$NaSiO3+CO2↑ 下列有关说法不正确是( )
| A. | 反应①是熵减小的反应,而反应②是熵增大的反应 | |
| B. | 反应②高温时能自发迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事实说明的H2SiO3酸性有时比H2CO3强,有时比H2CO3弱 | |
| D. | H2CO3酸性强于H2SiO3,不能用反应②进行解释 |

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.
 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.