题目内容
17.若要将12mol/L HCl稀释为500ml 1mol/L的稀盐酸,则需要12mol/L HCl的体积为多少mL?分析 根据溶液稀释时,溶质的物质的量不变即稀释定律C浓V浓=C稀V稀来计算.
解答 解:设需要12mol/L浓盐酸的体积为VmL,溶液稀释前后溶质物质的量不变即稀释定律C浓V浓=C稀V稀可知,
则12mol/L×VmL=1mol/L×500mL,
解得V=41.6mL,
答:需要41.6mL.
点评 本题考查溶液的稀释计算,学生应把握溶液稀释前后溶质的物质的量不变是解答的关键.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
8. 是某原子的结构示意图,下列关于该原子的描述正确的是( )
是某原子的结构示意图,下列关于该原子的描述正确的是( )
 是某原子的结构示意图,下列关于该原子的描述正确的是( )
是某原子的结构示意图,下列关于该原子的描述正确的是( )| A. | 容易得到电子 | B. | 属于非金属原子 | ||
| C. | 核电荷数为11 | D. | 最外层电子数为11 |
5.部分短周期元素的有关信息如表所示
根据表中信息,判断以下叙述正确的是( )
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
2.下列关于气体摩尔体积的说法正确的是( )
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
6.苯乙烯是化工产品中最重要的单体之一.在工业上,
苯乙烯由乙苯和CO2催化脱氢制得.总反应原理如下:
 (g)+CO2(g)?
(g)+CO2(g)?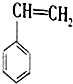 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H
回答下列问题:
(1)已知:
由乙苯制取苯乙烯反应的△H=+158.8KJ/mol
(2)在温度为T1时,该反应的平衡常熟K=0.5mol/L.在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得该混合物各组分的物质的量均为1.0mol.
①该时刻化学反应是(填“是”或“不是”)处于平衡状态.
②下列叙述能说明乙苯与C02在该条件下于平衡状态的是AD(填正确答案编号).
A.正、逆反应速率的比值恒定 B.c(CO2)=c(CO)
C.混合气体的密度不变 D.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度d(填正确答案编号).
a、大于0.5mol/L b、小于0.5mol/L c、等于0.5mol/Ld、不确定
(3)在温度为T2时的恒定容器中,乙苯、CO2的起始浓度分别为1.0mol/L和2.0mol/L,设反应平衡后总压强为P、起始压强为P0,则反应达到平衡时苯乙烯的浓度为$\frac{5(P-{P}_{0})}{{P}_{0}}$,乙苯的转化率为$\frac{2.5(P-{P}_{0})}{{P}_{0}}$×100%(均用含P0、P的表达式表示).
(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式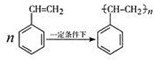 .
.
苯乙烯由乙苯和CO2催化脱氢制得.总反应原理如下:
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H回答下列问题:
(1)已知:
| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
(2)在温度为T1时,该反应的平衡常熟K=0.5mol/L.在2L的密闭容器中加入乙苯与CO2,反应到某时刻测得该混合物各组分的物质的量均为1.0mol.
①该时刻化学反应是(填“是”或“不是”)处于平衡状态.
②下列叙述能说明乙苯与C02在该条件下于平衡状态的是AD(填正确答案编号).
A.正、逆反应速率的比值恒定 B.c(CO2)=c(CO)
C.混合气体的密度不变 D.CO2的体积分数保持不变
③若将反应改为恒压绝热条件下进行,达到平衡时,则乙苯的物质的量浓度d(填正确答案编号).
a、大于0.5mol/L b、小于0.5mol/L c、等于0.5mol/Ld、不确定
(3)在温度为T2时的恒定容器中,乙苯、CO2的起始浓度分别为1.0mol/L和2.0mol/L,设反应平衡后总压强为P、起始压强为P0,则反应达到平衡时苯乙烯的浓度为$\frac{5(P-{P}_{0})}{{P}_{0}}$,乙苯的转化率为$\frac{2.5(P-{P}_{0})}{{P}_{0}}$×100%(均用含P0、P的表达式表示).
(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式
 .
. 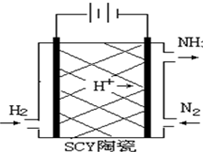 科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.
科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.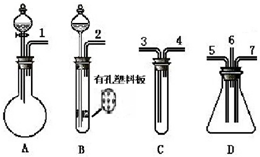 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示: