题目内容
13.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )| A. | 2-甲基丙烷 | B. | 环戊烷 | C. | 2,2-二甲基丁烷 | D. | 乙苯 |
分析 先确定有机物的对称中心,即找出等效的氢原子,再根据先中心后外围的原则,将氯原子逐一去代替氢原子,有几种氢原子就有几种一氯代烃,注意反应光照的条件,以此解答该题,
解答 解:A.2-甲基丙烷的结构简式为:CH3CH(CH3)CH3,其分子中有2种等效氢原子,其一氯代物有2种,故A错误;
B.环戊烷只有1种H,则一氯代物只有一种,故B正确;
C.2,2-二甲基丁烷的结构简式为:CH3C(CH3)2CH2CH3,其分子中含有3种等效氢原子,其一氯代物有3种,故C错误;
D.乙苯的结构简式为: ,光照条件下只取代乙基的H,其一氯代物有2种,故D错误.
,光照条件下只取代乙基的H,其一氯代物有2种,故D错误.
故选B.
点评 本题考查了同分异构体的判断,为高频考点,题目难度不大,注意掌握同分异构体的概念及求算方法,明确烃中等效氢原子数目的求算方法为解答本题的关键,试题培养了学生的灵活应用能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
4.下列说法正确的是( )
| A. | PM2.5亦称可入肺颗粒物,表面积相对较大,会吸附有害物质 | |
| B. | 煤的气化和石油的分馏都是物理变化 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | “嫦娥”三号使用的碳纤维是一种新型的有机高分子材料 |
1.下列烷烃的系统命名中,不正确的是( )
| A. | 3,4-二甲基戊烷 | B. | 2,3-二甲基丁烷 | ||
| C. | 丁烷 | D. | 2,2,3,3-四甲基丁烷 |
8.实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:

有关数据列表如下:
回答下列问题:
(1)在装置C中应加入c(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水②浓硫酸③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(4)反应过程中需用冷水冷却(装置e),其主要目的是避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞.
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过消去反应制得乙炔,反应的化学方程式为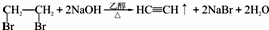 ;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$
;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$ .
.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在装置C中应加入c(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水②浓硫酸③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是溴的颜色完全褪去.
(3)若产物中有少量未反应的Br2,最好用②(填正确选项前的序号)洗涤除去.
①水②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(4)反应过程中需用冷水冷却(装置e),其主要目的是避免溴的大量挥发;但不用冰水进行过度冷却,原因是:1,2-二溴乙烷的凝固点较低,过度冷却会使其凝固而使气路堵塞.
(5)以1,2-二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2-二溴乙烷通过消去反应制得乙炔,反应的化学方程式为
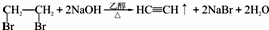 ;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$
;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$ .
.
18.硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同.设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分.

(1)B装置的作用是检验产物中是否有水生成.
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有SO2气体产生,写出D中发生反应的离子方程式SO2+H2O2+Ba2+=BaSO4↓+2H+.若去掉C,能否得出同样结论否(填“是”或“否”),原因是若有SO3也有白色沉淀生成.
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容.(试剂,仪器和用品自选)
(4)若E中收集到的气体只有N2,其物质的量为xmol,固体残留物Fe2O3的物质的量为ymol,D中沉淀物质的量为zmol,则x、y和z应满足的关系为3x+y=z.
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式2(NH4)2Fe(SO4)2═Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O.

(1)B装置的作用是检验产物中是否有水生成.
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有SO2气体产生,写出D中发生反应的离子方程式SO2+H2O2+Ba2+=BaSO4↓+2H+.若去掉C,能否得出同样结论否(填“是”或“否”),原因是若有SO3也有白色沉淀生成.
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请帮他完成表中内容.(试剂,仪器和用品自选)
| 实验步骤 | 预期现象 | 结论 |
| 取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | 若高锰酸钾溶液不褪色,加入KSCN溶液后变红 | 固体残留物仅为Fe2O3 |
(5)结合上述实验现象,完成硫酸亚铁铵在500℃时隔绝空气加热完全分解的化学方程式2(NH4)2Fe(SO4)2═Fe2O3+2 NH3↑+N2↑+4SO2↑+5H2O.
5.有4种碳架如下的烃,下列说法正确的是( )


| A. | a和b互为同分异构体 | B. | b和c是同系物 | ||
| C. | a和b都能发生加成反应 | D. | 只有b和c能发生取代反应 |
13.环境污染与资源短缺问题日趋突出,高效循环利用资源显得尤为重要.工业上用含有Cu2O、Al2O3、Fe2O3和SiO2的矿渣提取铜的工艺流程如图:

已知:①Cu2O+2H+=Cu+Cu2++H2O
②几种氢氧化物开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)固体A 主要由两种物质组成,其化学式为SiO2、Cu.
(2)酸浸、过滤后,滤液中铁元素的存在形式为Fe2+(填离子符号),生成该离子的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)沉淀B的化学式为Fe(OH)3,氧化过程中发生反应的离子方程式为2Fe2++ClO-+2CO32-+3H2O=Fe(OH)3↓+Cl-+2CO2↑.
(4)加NaOH调节溶液pH的范围是5.2≤pH<5.4,工业上对沉淀B、沉淀C的利用应采取的处理方法是加热分解得到相应的氧化物,用于冶炼铁和铝.

已知:①Cu2O+2H+=Cu+Cu2++H2O
②几种氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 4.0 | 5.8 | 1.1 | 5.4 |
| 完全沉淀的pH | 5.2 | 8.8 | 3.2 | 6.7 |
(1)固体A 主要由两种物质组成,其化学式为SiO2、Cu.
(2)酸浸、过滤后,滤液中铁元素的存在形式为Fe2+(填离子符号),生成该离子的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)沉淀B的化学式为Fe(OH)3,氧化过程中发生反应的离子方程式为2Fe2++ClO-+2CO32-+3H2O=Fe(OH)3↓+Cl-+2CO2↑.
(4)加NaOH调节溶液pH的范围是5.2≤pH<5.4,工业上对沉淀B、沉淀C的利用应采取的处理方法是加热分解得到相应的氧化物,用于冶炼铁和铝.
