题目内容
18.氢氧化钡是一种使用广泛的化学试剂.某课外小组通过下列实验测定某试样中Ba(OH)2•nH2O的含量.(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,用0.100mol/LHCl溶液中和,共消耗盐酸20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量.
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2•nH2O中的n值.
分析 (1)根据方程式Ba(OH)2+2HCl═BaCl2+2H2O,结合消耗盐酸的体积计算出10mL溶液中Ba(OH)2的物质的量,进而计算出试样中氢氧化钡的物质的量;
(2)试样加热后,固体质量减少为结晶水的质量,根据n=$\frac{m}{M}$计算结晶水的物质的量,根据(1)3.50g试样含有Ba(OH)2的物质的量计算5.25g试样含有Ba(OH)2的物质的量,利用Ba(OH)2的物质的量与结晶水的物质的量关系计算n的值.
解答 解:(1)20.0mL0.100mol•L-1 盐酸溶液中HCl的物质的量为0.02mol×0.1mol/L=0.002mol,设取出的10mL溶液中氢氧化钡的物质的量为x,则:
Ba(OH)2+2HCl═BaCl2+2H2O,
1mol 2mol
x 0.002mol
故x=0.001mol
则3.50g试样含有Ba(OH)2的物质的量为0.001mol×$\frac{100mL}{10mL}$=0.01mol,
答:3.50g试样含有Ba(OH)2的物质的量为0.01mol;
(2)5.25g试样中含有Ba(OH)2的物质的量为0.01mol×$\frac{5.25g}{3.5g}$=0.015mol,含有水的物质的量为$\frac{5.25g-3.09g}{18g/mol}$=0.12mol,所以1:n=0.015mol:0.12mol,解得n=8,答:Ba(OH)2•nH2O中的n值是8.
点评 本题考查根据方程式的有关计算以及质量分数的计算等,难度不大,根据所学知识即可完成.

练习册系列答案
相关题目
8.下列属于非电解质的是( )
| A. | 铝 | B. | 碳酸钙 | C. | 氢氧化钡 | D. | 苯 |
9.氯化钠是典型的离子晶体,下列有关氯化钠晶体结构的有关叙述错误的是( )
| A. | 钠离子与氯离子之间通过静电吸引结合在一起 | |
| B. | 与某个钠离子最接近的钠离子有12个 | |
| C. | 某个钠离子周围的氯离子围成的空间结构为正八面体 | |
| D. | 晶体中钠离子的半径比氯离子的半径小 |
6.已知下列事实:
①硝酸的酸性比磷酸强
②硝酸的氧化性比磷酸强
③氮气与氢气可直接化合,磷与氢气很难直接化合
④氨气比磷化氢稳定
其中能说明氮元素的非金属性比磷元素强的是( )
①硝酸的酸性比磷酸强
②硝酸的氧化性比磷酸强
③氮气与氢气可直接化合,磷与氢气很难直接化合
④氨气比磷化氢稳定
其中能说明氮元素的非金属性比磷元素强的是( )
| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
13.1mol/L的Na2SO4溶液是( )
| A. | 溶液中含有1mol Na2SO4 | |
| B. | 1升水中加入142g Na2SO4 | |
| C. | 1mol Na2SO4溶于1mol水中 | |
| D. | 将322g Na2SO4•10H2O溶于少量水后再稀释成1000mL |
3.下列关于焰色反应的说法不正确的是( )
| A. | 只有金属化合物才有焰色反应 | |
| B. | 只有某些金属或其化合物才有焰色反应 | |
| C. | 透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色 | |
| D. | 每次焰色反应实验后都要将铂丝蘸取盐酸洗涤并灼烧 |
10.下列实验装置或操作正确的是( )
| A. |  浓硫酸稀释 | B. |  除去Cl2中的HCl气体 | ||
| C. |  蒸馏装置 | D. |  转移溶液 |
7.有变价的金属与硫反应,硫常常把这些金属氧化成低价态.钠、铝、铁、铜分别跟硫反应,下面生成的硫化物不正确的是( )
| A. | Na2S | B. | Al2S3 | C. | FeS | D. | CuS |
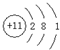 .C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).
.C、D、E的简单离子半径由小到大的顺序Al3+<Na+<O2-( 用离子符号表示).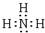 .检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.
.检验该气体的常用方法是用润湿的红色石蕊试纸接近该气体,若试纸变蓝,证明氨气存在.