��Ŀ����
����Ŀ��ij��ѧ��ȤС����̽���������ʵ����ʼ��Ʊ���
��̽��һ��ѡ�������װ�ú�ҩƷ̽��������������������ǿ����
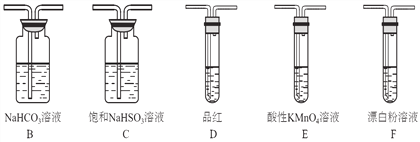
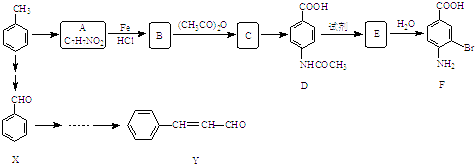
��1��װ��A��ʢҺ��IJ�������������____________��װ��A�з�Ӧ�Ļ�ѧ����ʽΪ________________________________��
��2��װ������˳��ΪA��C��_______��_______��D��F������װ��C��������_________��ͨ������_________________________________������֤�������������ǿ�ڴ����ᡣ
��̽�����������������ƣ�Na2S2O4���׳Ʊ��շۣ��㷺���ڷ�֯��ҵ�Ļ�ԭ��Ⱦɫ����ϴ��ӡ������ɫ�Լ�֯���Ư�ȡ���ȡ���շ�ͨ����Ҫ��������
��3����ȡNa2S2O4���ü����Ʒ��������¶�70-80�棬�ڼ״���Һ���ܼ������ܽ�����ƣ�HCOONa�����ٵμ�Na2CO3��ҺͬʱͨSO2ά����Һ���ԣ���������Na2S2O4���÷�Ӧ�����ӷ���ʽ_________________________________��
��4���ⶨ���շ۴��ȡ�Na2S2O4����ǿ��ԭ������¶�ڿ������ױ�����������Na2S2O4��KMnO4������Һ������Ӧ��5Na2S2O4+6KMnO4+4H2SO4�T5Na2SO4+3K2SO4+6MnSO4+4H2O����ȡ5.0gNa2S2O4��Ʒ������ˮ�У����100mL��Һ��ȡ��10mL����Һ����ƿ�У���0.10molL��1��KMnO4��Һ�ζ����ظ���������2�Σ�ƽ������KMnO4��Һ21.00mL�������Ʒ��Na2S2O4����������Ϊ_______________�����ʲ����뷴Ӧ����
���𰸡� ��Һ©�� CaSO3+2HCl=CaCl2+SO2��+H2O B E ��ȥHCl���� װ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ���� 2HCOO-+4SO2+CO32-=2S2O42-+H2O+3CO2 60.9%
����������1����װ��A֪ʢҺ��IJ������������Ƿ�Һ©����װ��A�з�Һ©����ʢ��Һ��Ϊ���ᣬ��ƿ��װ����CaSO3���������߿��Է�����Ӧ������CaCl2�Ͷ�������ˮ����Ӧ�Ļ�ѧ��Ӧ����ʽΪCaSO3+2HCl=CaCl2 +SO2��+H2O��
(2)װ��A�Ʊ�SO2�����ڴ������ξ���ǿ�����ԣ���˸��ݽ�ǿ���Ʊ�������֪����SO2ͨ��̼��������Һ�У������CO2���壬���������Ը��������Һ��ȥ��������е�SO2������Ʒ����Һ�����Ƿ����������CO2ͨ��Ư����Һ�м���ʵ��������������������ǿ���Ƚϣ�����װ������˳��ΪACBEDF������װ��C�������dz�ȥHCl���塣ͨ������װ��D��Ʒ����Һ����ɫ��˵��SO2�Ѿ�������CO2��F�е�Ư����Һ������Ӧ������̼��ư�ɫ������˵��̼������Աȴ�����ǿ��������������ֱ�̼��ǿ������װ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ����������֤�������������ǿ�ڴ����ᡣ�𰸣� B.Eװ��D��Ʒ����Һ����ɫ��F�г��ְ�ɫ������
3��1������ԭ���غ�͵��ӵ�ʧ�غ��֪��Ӧ�����ӷ���ʽΪ2HCOO-+4SO2+CO32-=2S2O42-+H2O+3CO2��
��2�����ĸ�����ص����ʵ�����0.0021mol�����ݷ���ʽ��֪����Na2S2O4�����ʵ�����0.0021mol��5/6=0.00175mol�����ԭNa2S2O4�����ʵ�����0.0175mol�������Ʒ��Na2S2O4����������Ϊ![]() ��
��

����Ŀ��ijͬѧ�������ʵ���Ũ��Ϊ0.100 0molL��1������ⶨδ֪���ʵ���Ũ�ȵ�����������Һ��ѡ���̪��ָʾ��������д���пհף�
��1���ñ�������ζ����������������Һʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ��ֱ�������һ�����ᣬ��Һ �� ����ֹͣ�ζ���
��2�����в����п���ʹ��������������Һ��Ũ����ֵƫ�͵���������ţ���
A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B.�ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
E.�ζ������У���ƿ�����ڼ��ң�ʹ������Һ����
��3����ij�εζ�����ʱ����ʽ�ζ����е�Һ����ͼ��ʾ��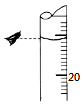
�����Ϊ mL�������ӣ���ʹ����ƫ�����С������
��4���ٽ�ϱ����ݣ����㱻������������Һ�����ʵ���Ũ���� molL��1 ��
�ζ� | ������Һ | ������� | |
�ζ�ǰ�Ŀ̶�/mL | �ζ���Ŀ̶�/mL | ||
��һ�� | 10.00 | 1.34 | 19.39 |
�ڶ��� | 10.00 | 4.10 | 21.10 |
������ | 10.00 | 0.40 | 17.60 |