题目内容
10.现有铁的某种氧化物2.32g,被CO完全还原后,将生成的气体通过足量的澄清石灰水,过滤得到4g沉淀,则该铁的氧化物的化学式是Fe3O4.分析 根据沉淀的质量算出二氧化碳的质量,然后根据二氧化碳的质量计算出氧化物的化学式.
解答 解:设生成11克沉淀需要二氧化碳为x,
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 4
$\frac{44}{x}=\frac{100}{4}$
x=1.76g,
设铁的氧化物是Fe2Ox
Fe2Ox~~~xCO2
112+16x 44x
2.32g 1.76g
$\frac{112+16x}{2.32g}=\frac{44x}{1.76g}$
X=$\frac{8}{3}$
氧化物的化学式为:Fe3O4,故答案为:Fe3O4.
点评 在解此类题时,首先分析题中的反应关系,然后根据题中的数据列出比例关系进行解答.

练习册系列答案
相关题目
20. 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如图:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如图:
请回答:
(1)根据如图,合成氨的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.
(2)取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2kJ(填“大于”“等于”或“小于”),原因是该反应是可逆反应,反应物无法全部转化为生成物;若加入催化剂,△H不变(填“变大”“变小”或“不变”).
(3)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,则破坏1mol N-H键需要吸收的能量为391kJ.
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物.发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g).
已知:N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1.
则:1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85kJ•mol-1.
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如图:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如图:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
(1)根据如图,合成氨的热化学方程式是N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ•mol-1.
(2)取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量小于92.2kJ(填“大于”“等于”或“小于”),原因是该反应是可逆反应,反应物无法全部转化为生成物;若加入催化剂,△H不变(填“变大”“变小”或“不变”).
(3)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,则破坏1mol N-H键需要吸收的能量为391kJ.
(4)N2H4可视为:NH3分子中的H被-NH2取代的产物.发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g).
已知:N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1.
则:1mol N2H4与NO2完全反应的热化学方程式为N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85kJ•mol-1.
18.氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%=35.453中( )
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 35.5表示氯元素的近似相对原子质量 | |
| C. | 24.23%表示35Cl的丰度 | |
| D. | 36.966表示37Cl的质量数 |
5.下列关于纯水的说法不正确的是( )
| A. | 纯水具有较弱的导电性 | B. | 水分子在任何条件下都能发生电离 | ||
| C. | 常温下水能发生电离 | D. | 水的电离是一个可逆反应 |
6.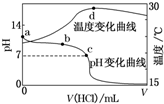 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14 mol•L-1 | |
| B. | b点:c(NH${\;}_{4}^{+}$)+c(NH3•H2O)=c(Cl-) | |
| C. | c点:c(Cl-)=c(NH${\;}_{4}^{+}$) | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
7.下列叙述中不正确的是( )
| A. | 从柑桔中可提炼出苧烯(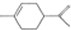 ),其分子式为C10H16,是1,3丁二烯的同系物 ),其分子式为C10H16,是1,3丁二烯的同系物 | |
| B. | 化学式为C4H10O的醇可被氧化成醛的有2种 | |
| C. | 2-氯丁烷(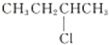 )与NaOH乙醇溶液共热发生消去反应的产物有2种 )与NaOH乙醇溶液共热发生消去反应的产物有2种 | |
| D. | 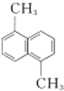 与 与 的一氯代物的数目不相等 的一氯代物的数目不相等 |