题目内容
已知某铵根离子NH3D+中,N原子的质量数为14,H原子的质量数为1,D原子(1种氢原子)的质量数为2,则其电子数、质子数、中子数三者之比为( )?A.10∶7∶11 B.11∶11∶8? C.10∶11∶8 D.10∶12∶9?
解析:本题有2种解法,计算法和推断法。
方法1(计算法):首先可计算出NH3D+离子的质子数之和为7+1×3+1=11;因此电子数之和为11-1=10,中子数为质量数之和:14+1×3+2=19减去质子数之和等于8。
方法2(推断法):根据阳离子中质子数和电子数的关系,该离子带一个单位的正电荷,因此,质子数应该比电子数多一,选项中只有C项符合该条件。
答案:C

练习册系列答案
相关题目
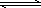 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的ΔH________(填“增大”“减小”或“不改变”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的ΔH________(填“增大”“减小”或“不改变”).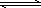 NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10-5 mol·L-1)
NH3·H2O+H+,则该反应常温下的平衡常数K=________(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10-5 mol·L-1)