题目内容
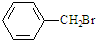
16.可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6 区分开的试剂是( )| A. | FeCl3溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | NaOH溶液 |
分析 C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液、C6H6分别FeCl3溶液反应的现象分别为:不反应不分层、白色沉淀、不反应分层后油状液体在下层、溶液为褐色、溶液为紫色、不反应分层后油状液体在上层,现象不同,以此解答.
解答 解:A.C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液、C6H6分别FeCl3溶液反应的现象分别为:不反应不分层、白色沉淀、不反应分层后油状液体在下层、溶液为褐色、溶液为紫色、不反应分层后油状液体在上层,现象不同,能区分开,故A正确;
B.加入溴水,现象分别为:不反应不分层、浅黄色沉淀、不反应分层后油状液体在下层、溶液呈褐色、白色沉淀、不反应分层后油状液体在上层,现象不同,可鉴别,故B正确;
C.C2H5OH、苯酚均与高锰酸钾溶液反应,现象相同,不能区分,故C错误;
D.C2H5OH、KI溶液与NaOH溶液均不反应不分层,现象相同,不能区分,故D错误;
故选AB.
点评 本题考查物质的区分,注意利用反应的不同现象来区分是解答的关键,侧重物质性质的考查,明确常见有机物、无机物之间的反应即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.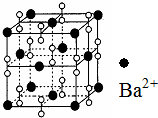 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
 钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该氧化物的电子式为 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有6个 |
11.下列说法正确的是( )
| A. | 1H、2H、3H、H2都是氢元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
1.25℃,向1LpH=a的NaOH溶液中滴加pH=b的盐酸10L时,刚好完全中和,则(a+b)的值为( )
| A. | 13 | B. | 14 | C. | 15 | D. | 12 |
8.①制备纳米TiO2的方法之一是TiCl4水解生成TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
请回答下列问题:
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl.
(2)配制成250mL溶液使用的量具是250mL容量瓶,指示剂还可用甲基橙;
(3)滴定终点的现象是浅红色溶液变为无色,30秒内不褪色.
(4)滤液中溶质的物质的量浓度为0.1250 mol L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(1)TiCl4水解生成TiO2•xH2O的化学方程式为TiCl4+(x+2)H2O?TiO2•xH2O↓+4HCl.
(2)配制成250mL溶液使用的量具是250mL容量瓶,指示剂还可用甲基橙;
(3)滴定终点的现象是浅红色溶液变为无色,30秒内不褪色.
(4)滤液中溶质的物质的量浓度为0.1250 mol L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
6.下列反应属于氧化还原反应的是( )
| A. | CaCO3+2HCl=CaCl2+CO2↑+H2O | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | CaO+H2O=Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |