题目内容
某厂废水中含5.00×10-3
mol·L-1的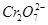 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
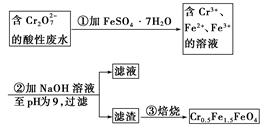
(1)第①步反应的离子方程式是__________________________________________________
________________________________________________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是:_______________________________________
________________________________________________________________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有________________。
(4)欲使1 L该废水中的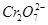 完全转化为Cr0.5Fe1.5FeO4,理论上需要加入____________g FeSO4·7H2O。
完全转化为Cr0.5Fe1.5FeO4,理论上需要加入____________g FeSO4·7H2O。
(1) +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
(2)将一小片pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照 (3)Fe(OH)3、Fe(OH)2 (4)13.9
【解析】
试题分析:(1) 有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,
有较强氧化性,FeSO4·7H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应, 转化为Cr3+,Fe2+转化为Fe3+。
转化为Cr3+,Fe2+转化为Fe3+。
 +14H++6Fe2+===2Cr3++6Fe3++7H2O。
+14H++6Fe2+===2Cr3++6Fe3++7H2O。
(2)应将试纸展放在表面皿上,用玻璃棒蘸取待测液滴在试纸中部,再与标准比色卡对照得出pH。
(3)由题给框图可得:Fe2+过量,加NaOH溶液时,产生Cr(OH)3、Fe(OH)3和Fe(OH)2三种沉淀。
(4)1 L废水中含n( )=5.00×10-3
mol。
)=5.00×10-3
mol。
由题意得: ~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,
~4Cr0.5Fe1.5FeO4~10FeSO4·7H2O,
所以理论上n(FeSO4·7H2O)=10n( )=0.05 mol。
)=0.05 mol。
m(FeSO4·7H2O)=0.05 mol×278 g·mol-1=13.9 g。
考点:考查物质的分离和提纯、化学实验基本操作、化学计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,注重考查学生分析问题、解决问题的能力。这类试题要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案
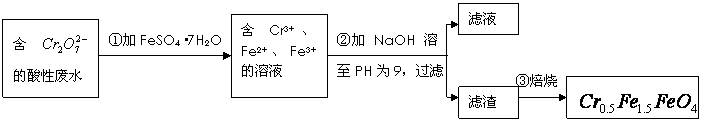

 ,其毒性较大。某研究性学习小组为了变
,其毒性较大。某研究性学习小组为了变 (
( 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
