题目内容
(08浙江金丽衢十二校联考) (10分)根据测定硫酸铜晶体中结晶水含量的实验,填写下列空白:
⑴ 有下列仪器,本实验中需要的仪器是(填写字母)___________________________,除上述仪器外,还需要的仪器是(填仪器名称): ________________________________。
A、带砝码的托盘天平 B、研钵 C、试管夹 D、酒精灯 E、蒸发皿
F、玻璃棒 G、坩埚 H、干燥管 I、石棉网 J、三角架
⑵ 本实验至少需要加热_____________次,至少需要称量__________次;
⑶ 某学生实验得到以下数据:加热前容器的质量为m1,容器和晶体的总质量为m2,加热后容器和无水CuSO4的总质量为m3。请写出结晶水含量(ω)的计算公式并求出CuSO4?nH2O中n的值(用ml、m2、m3表示): ω= ____________________,n = _____________________
⑷ 若ml = 5.4g、m2 = 7.9g、m3 = 6.8g,该生测得实验结果偏高还是偏低? _______________
从下列分析中选出该生实验产生误差的原因可能是(填写字母) ___________________
A、加热前称量时容器未完全干燥 B、最后两次加热后的质量差大于0.1g
C、加热后容器未放在干燥容器中冷却 D、加热过程中有少量晶体溅出
E、加热后的粉末中有少量黑色固体
答案: (10分) (1) A、B、D、F、G、J;泥三角、坩埚钳、干燥器
![]()
(2) 2 4
(4) 偏高; A、D、E

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案2(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
 |
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
(08皖南8校第三次联考)1 L某混合溶液,可能含有的离子如下表:
可能大量还有的阳离子 |
|
可能大量还有的阴离子 |
|
 (1)往该溶液中逐滴加入
(1)往该溶液中逐滴加入![]() 溶液并适当
溶液并适当
加热,产生沉淀和气体的物质的量(![]() )
)
与加入![]() 溶液的体积(V)的关系
溶液的体积(V)的关系
如右图所示。则该溶液中确定含有的离子
有_______________;不能确定是否含有
的阳离子有______________,要确定其存
在可补充做的实验是___________;肯定不存在的阴离子有_________________。
(2)经检测,该溶液中含有大量的![]() ,若向1 L该混合溶液中通入―定晕的
,若向1 L该混合溶液中通入―定晕的![]() ,溶液中
,溶液中![]() 的物质的量与通入
的物质的量与通入![]() 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:

 (08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
(08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()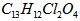
 溶液发生显色反应
溶液发生显色反应 。下列说法正确的是()
。下列说法正确的是() A.a极为电池的正极
A.a极为电池的正极
 厍仑的电量
厍仑的电量  ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol