题目内容
4.已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示.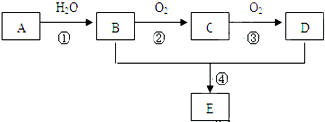
请回答下列问题:
(1)写出A的结构式
 .
.(2)B、D分子中官能团的名称是羟基、羧基.
(3)下列物质中,既能使溴水褪色,又能使酸性高锰酸钾褪色的是①④
①乙烯 ②苯 ③乙烷 ④二氧化硫.
分析 A的产量通常用来衡量一个国家的石油化工水平,则A为乙烯,乙烯含有碳碳双键,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到E为CH3COOCH2CH3,据此解答.
解答 解:A的产量通常用来衡量一个国家的石油化工水平,则A为乙烯,乙烯含有碳碳双键,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到E为CH3COOCH2CH3,
(1)乙烯含有碳碳双键,结构式为 ,故答案为:
,故答案为: ;
;
(2)B为CH3CH2OH,D为CH3COOH,乙醇和乙酸含有的官能团分别是羟基和羧基,故答案为:羟基;羧基;
(3)乙烯能与溴水加成,也能与酸性高锰酸钾发生氧化还原,二氧化硫能被溴水或酸性高锰酸钾氧化,而苯和乙烷 与溴水或高锰酸钾都没有反应,所以既能使溴水褪色,又能使酸性高锰酸钾褪色的是乙烯和二氧化硫,故选①④.
点评 本题考查有机物的推断,题目难度中等,涉及有机反应类型的判断、有机方程式书写、官能团的判断等知识,明确常见有机物结构与性质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.下列有关描述正确的是( )
| A. | 两种同位素137Cs和133Cs形成的单质化学性质几乎完全相同 | |
| B. | 非金属元素的原子半径越小越容易得电子,该元素最高价氧化物的水化物酸性一定也越强 | |
| C. | 随原子序数的增大,碱金属元素单质的密度逐渐增大,ⅦA元素的单质的熔沸点逐渐升高 | |
| D. | 主族元素A、B、C、D的离子aA2+、bB+、cC2-、dD-(n为正整数)具有相同的电子层结构,则原子序数大小关系为a>b>c>d |
15.在化学学习中使用数轴的表示方法可收到直观、形象的效果,下列表达中正确的是( )
| A. | 分散质微粒的大小与分散系种类的关系: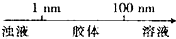 | |
| B. | 常温下溶液的pH其酸碱性的关系: | |
| C. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| D. | Na与O2反应的产物: |
12.原子利用率=期望产物的总质量与生成物的总质量之比,原子利用率越高对环境污染越小.在下列制备环氧乙烷的反应中,原子利用率最高的是( )
| A. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$ +HOCH2═O═CH2OH+2H2O +HOCH2═O═CH2OH+2H2O | B. | CH2═CH2+Cl2+Ca(OH)2? +CaCl2+H2O +CaCl2+H2O | ||
| C. | CH2═CH2+ (过氧乙酸)? (过氧乙酸)? +C3HCOCH +C3HCOCH | D. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$ |
19.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| B. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| C. | 1.0L的0.1 mol•L-1Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
9.一种塑料抗氧化剂C可通过下列反应合成:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 物质A中所有碳原子有可能位于同一平面 | |
| B. | 物质B可与4molH2发生加成反应 | |
| C. | 用酸性KMnO4溶液鉴别抗氧化剂C中是否含有CH3(CH2)17OH | |
| D. | B生成C的反应类型为取代反应 |
16.图为烃分子的球棍模型,“大球”表示碳原子,“小球”表示氢原子.下列说法正确的是( )
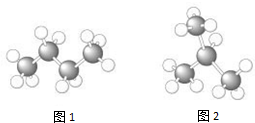

| A. | 图1表示的烃叫丙烷 | |
| B. | 图2烃分子的结构简式为CH3CH2CH2CH3 | |
| C. | 图1与图2表示的是同一种物质 | |
| D. | 图1与图2表示的物质互为同分异构体 |
