题目内容
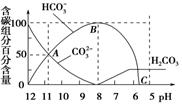
常温下在20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液的PH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示
回答下列问题:
(1)在0.1mol/L Na2CO3溶液所有阳离子和阴离子的浓度有何关系?(用等式表示)___________.
(2)当加入盐酸使溶液PH值为10时,混合液中含碳元素的离子物质的量之比为________.
(3)随着盐酸的加入,请写出BC段的离子方程式______________.
(4)当混合液的PH=________时,开始放出CO2气体.
解析:
|
(1)C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-)(2分) (2)n(CO32-)∶n(HCO3-)=1∶1(2分) (3)HCO3-+H+=CO2↑+H2O或HCO3-+H+=H2CO3(2分) (4)6(2分) |

|
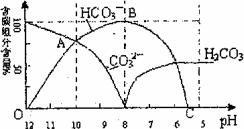
常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐渐滴加入0.1 mol/L HC1溶液40 mL,溶液的pH逐渐降低,下列说法正确的是(NA表示阿伏加德罗常数) | |
A. |
完全反应以后,溶液呈现中性 |
B. |
当盐酸加入20 mL时,溶液中NHCO3的物质的量为0.002NA |
C. |
20 mL 0.1 mol·L-1 Na2CO3溶液中c(Na+)+c(H+)=2c(CO |
D. |
20 mL 0.1 mol·L-1 Na2CO3溶液中c(H+)+2c(H2CO3)+c(HCO |
| |||||||||||||||||||||

 =2×10-4,当溶液中c(HCO
=2×10-4,当溶液中c(HCO