题目内容
一定条件、一定体积的CO2、CO、O2组成的混合气体全部转化为CO2,恢复到原条件,体积为90mL。原混合气体的体积可能是( )A.90mL B.100mL C.115mL D.135mL
解析:
| 2CO+O2 2 1 2 1 V 2V 2V V 由分析知 ∴ 原来气体体积V(总)=90+V 又V(总)=
又∵ ∴ V<45(mL) ∴ V(总)=90+V<135(mL) 又V(总)>90mL ∴ 90<V(总)<135
|

 全优点练单元计划系列答案
全优点练单元计划系列答案
| A、图①表示一定条件下某化学反应的速率随时间变化的趋势图,该反应一定为放热反应 | B、图②表示在四羟基合铝酸钠溶液中加入盐酸,产生沉淀的质量变化 | C、图③表示等体积、等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁粉,产生H2的物质的量的变化 | D、图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
(12分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g)2NO(g) △H=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0、86×10-4 | 2、6×10-4 | 64×10-4 |
①该反应的△H 0(填“>”、“=”或“<”)。
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,
请补充完成1760℃时N2的转化率随时间变化的示意图。
(2)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1) 的反应热△H= 。
(用含a的代数式表示)
(3)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为:N2+3H22NH3。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(4)合成氨的反应N2(g)+3H2(g)2NH3(g) △H =-92、4 kJ·mol-1,一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的措施是__________(填字母代号)。
a、升高温度 b、加入催化剂 c、增加H2的浓度
d、增加N2的浓度 e、分离出NH3
(5)在25℃下,将a mol·L-1的氨水与0、01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”),可推断a 0、01(填大于、等于或小于)。
KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将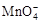 氧化C2O42−的离子方程式补充完整:
氧化C2O42−的离子方程式补充完整:
□MnO4− +□C2O42−+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
|
滴入KMnO4溶液的次序 |
KMnO4溶液紫色褪去所需的时间 |
|
先滴入第1滴 |
60 s |
|
褪色后,再滴入第2滴 |
15 s |
|
褪色后,再滴入第3滴 |
3 s |
|
褪色后,再滴入第4滴 |
1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
 下图所示(反应条件均已略去).
下图所示(反应条件均已略去).