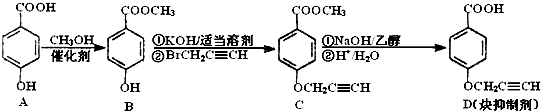
题目内容
某学生设计了如下实验:
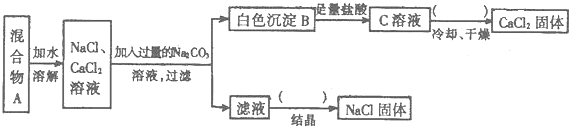
回答下列问题:
(1)该同学的实验目的是 ;
(2)如图括号内的操作均为 ;
(3)按此实验方案得到的NaCl固体中肯定含有 杂质(填化学式);为了解决这个问题可以向过滤得到的滤液中加入适量的 .

回答下列问题:
(1)该同学的实验目的是
(2)如图括号内的操作均为
(3)按此实验方案得到的NaCl固体中肯定含有
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:由分离流程可知,溶解后加过量碳酸钠,生成碳酸钙沉淀,则白色沉淀B为碳酸钙,B与盐酸反应生成氯化钙,C为氯化钙溶液,在HCl气流中蒸发、冷却、过滤得到氯化钙固体;滤液中含NaCl、碳酸钠,加足量盐酸反应后,蒸发结晶得到NaCl固体,以此来解答.
解答:
解:由分离流程可知,溶解后加过量碳酸钠,生成碳酸钙沉淀,则白色沉淀B为碳酸钙,B与盐酸反应生成氯化钙,C为氯化钙溶液,在HCl气流中蒸发、冷却、过滤得到氯化钙固体;因碳酸钠过量,滤液中含NaCl、碳酸钠,加足量盐酸反应后,蒸发结晶得到NaCl固体,
(1)由上述分析可知,原为固体混合物,实验可分离二者,则实验目的为分离CaCl2和NaCl两种固体混合物,故答案为:分离CaCl2和NaCl两种固体混合物;
(2)由上述分析可知,括号内的操作均为蒸发,故答案为:蒸发;
(3)由上述分析可知,NaCl固体中肯定含有Na2CO3,应加适量的稀盐酸反应后蒸发,故答案为:Na2CO3;稀盐酸.
(1)由上述分析可知,原为固体混合物,实验可分离二者,则实验目的为分离CaCl2和NaCl两种固体混合物,故答案为:分离CaCl2和NaCl两种固体混合物;
(2)由上述分析可知,括号内的操作均为蒸发,故答案为:蒸发;
(3)由上述分析可知,NaCl固体中肯定含有Na2CO3,应加适量的稀盐酸反应后蒸发,故答案为:Na2CO3;稀盐酸.
点评:本题考查混合物分离提纯方法及综合应用,为高频考点,把握实验流程中发生的反应、混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列离子方程式正确的是( )
| A、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | ||||
| B、钠与水的反应:2Na+2H2O═2 Na++2OH-+H2↑ | ||||
| C、稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | ||||
D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
|
下列关于难溶电解质AgBr的说法正确的是( )
| A、在一定温度下,AgBr水溶液中c(Br-)和c(Ag+)的乘积是一个常数 |
| B、AgBr水溶液的导电能力很弱,所以AgBr为弱电解质 |
| C、室温下,AgBr在纯水中的溶解度大于在KBr溶液中的溶解度 |
| D、向饱和AgBr悬浊液中加入盐酸c(Br-)增大,Ksp值变大 |
化学工作者从有机反应RH+Cl2(g)
RCl(l)+HCl(g)受到启发提出的在农药和有机合成工业中可获得副产品HCl的设想已成为现实,试指出由上述反应产物分离得到盐酸的最佳方法是( )
| 光照 |
| A、水洗分液法 | B、蒸馏法 |
| C、升华法 | D、有机溶剂萃取法 |
一定温度下,下列溶液的离子浓度关系式正确的是( )
| A、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol?L-1 |
| B、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C、pH=2的H2S溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HS-) |
| D、pH相同的①CH3COONa②NaHCO3两种溶液的c(Na+):①>② |

 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式