题目内容
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是![]()
![]()

A.该物质与苯酚属于同系物,遇![]() 溶液呈紫色
溶液呈紫色
B.滴入酸性![]() 溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和![]() 反应时最多消耗
反应时最多消耗![]() 和
和![]() 分别为4mol和7mol
分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
【答案】C
【解析】
由有机物的结构简式可知,分子中含碳碳双键、酚![]() ,结合烯烃、酚的性质及苯环的平面结构来解答。
,结合烯烃、酚的性质及苯环的平面结构来解答。
A. 苯酚同系物中只含1个苯环,该物质含2个苯环,不是苯酚同系物,但含酚![]() ,遇
,遇![]() 溶液呈紫色,故A错误;
溶液呈紫色,故A错误;
B. 碳碳双键、酚![]() 均能被氧化,滴入酸性
均能被氧化,滴入酸性![]() 溶液振荡,紫色褪去,不能证明其结构中存在碳碳双键,故B错误;
溶液振荡,紫色褪去,不能证明其结构中存在碳碳双键,故B错误;
C. 酚![]() 的邻对位与溴水发生取代,碳碳双键与溴水发生加成,则1mol该物质与浓溴水反应,消耗溴为4mol;苯环与碳碳双键均与氢气发生加成,则1mol该物质与氢气反应时,消耗氢气为7mol,故C正确;
的邻对位与溴水发生取代,碳碳双键与溴水发生加成,则1mol该物质与浓溴水反应,消耗溴为4mol;苯环与碳碳双键均与氢气发生加成,则1mol该物质与氢气反应时,消耗氢气为7mol,故C正确;
D. 苯环、碳碳双键均为平面结构,且直接相连的原子在同一平面内,则该分子中的所有碳原子可能共平面,故D错误。
故选C。

 53随堂测系列答案
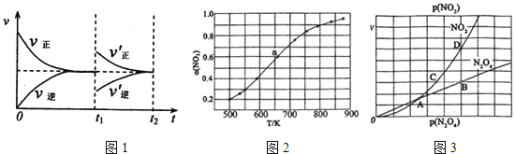
53随堂测系列答案【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)
2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。
由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度_________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“增大”“减小”或“不变”)