题目内容
【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)
2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。
由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度_________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“增大”“减小”或“不变”)
【答案】258.6 < = a=b+c D > 不变
【解析】
⑴根据盖斯定律求算焓变数字。
⑵根据反应是放热反应,K减小,即逆向移动,说明是向吸热反应移动,即升温;只加2 molC与原平衡是等效平衡即浓度相等,吸收的热量与放出的热量之和等于焓变。
⑶反应是可逆反应,要达到2akJ,则反应物应该比4molA,2molB还要多才有可能达到2a kJ。
⑷现在是恒压容器,由于是体积减小的反应,因此相当于再原来的基础上加压,平衡正向移动,又不断消耗,反应放出的热量更多。
⑸恒温恒压,不等体积反应要达到等效,只需要对应成比例,将2molC全部转化为A、B,比例和前面的比例相同,因此两者为等效平衡,A的百分含量不发生改变。
⑴将第2个方程式减去第1个方程式再除以2,得到![]() ,则a=258.6,故答案为:258.6。
,则a=258.6,故答案为:258.6。
⑵该反应是放热反应,T1到T2,K减小,即逆向移动,逆向为吸热反应反应,说明是升温即T1 < T2,故答案为:<。
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,说明与原来的平衡是等效平衡,即C的浓度 = ω mol·L-1,绝对等效平衡建立,一个正向建立,一个逆向建立,则吸收的热量和放出的热量相加等于焓变数字,即a = b + c,故答案为:=;a = b + c。
(3)A选项,由于是可逆反应,因此4 mol A和2 mol B反应放出的热量小于2a kJ,故A错误;
B选项,由于是可逆反应,因此4 mol A、2 mol B反应放出的热量小于2a kJ,2 mol C反应还需要吸收热量,因此整个放出的热量小于2a kJ,故B错误;
C选项,由于是可逆反应,4 mol A和4 mol B反应,4 molA不可能全部反应完,因此放出的热量小于2a kJ,故C错误;
D选项,6 mol A和4 mol B参与反应,有可能完全反应完4 mol A和4 mol B,则放出的热量为2a kJ,故D正确。
综上所述,答案为D。
(4)容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,该反应是体积减小的反应,相当于再原来的基础上加压,平衡正向移动,即放出的热量更多,因此d>b,故答案为:>。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,将2 molC全部转化为反应物,即相当于加了2molA和1molB,即4 mol A、3 mol B和2 mol C相当于加了6molA和4molB,与开始是等效的,A的百分含量不变,故答案为:不变。

 阅读快车系列答案
阅读快车系列答案【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
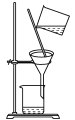
(1)喷泉实验,证明氨气极易溶于水,选用__(填序号,下同)。
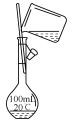
(2)配制100mL0.1mol·L-1NaOH溶液,选用__。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用于分离泥沙与食盐溶液,选用__。