题目内容
13.向含有ag硝酸的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解.已知有$\frac{a}{4}$g硝酸被还原,则a:b不可能是( )| A. | 3:1 | B. | 9:2 | C. | 2:1 | D. | 4:1 |
分析 硝酸具有强氧化性,铁具有还原性.硝酸过量,铁被氧化成+3价,铁过量,过量的铁与产物硝酸铁反应,生成硝酸亚铁.因此,硝酸与铁反应,产物可能为硝酸铁和水;也可能为硝酸亚铁和水;也可能为硝酸铁、硝酸亚铁和水,据此分析解答.
解答 解:n(Fe)=$\frac{bg}{56g/mol}$=$\frac{b}{56}$mol,n(HNO3)=$\frac{a}{63}$mol
(1)设生成硝酸亚铁:
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
3 8
$\frac{b}{56}$mol $\frac{a}{63}$mol
a:b=3:1
当a:b=3:1时,含有ag硝酸的稀溶液跟bg铁恰好反应,产物为硝酸铁和水;
(2)设生成硝酸铁:
Fe+4HNO3 =Fe(NO3)3+NO↑+2H2O
1 4
$\frac{b}{56}$mol $\frac{a}{63}$mol
a:b=9:2
当a:b=9:2时,含有ag硝酸的稀溶液跟bg铁恰好反应,产物为硝酸亚铁和水;
(3)设硝酸铁、硝酸亚铁和水.此时a:b介于3:1与9:2之间,即3--4.5之间,选项②3:2 不在此范围;
故选C.
点评 本题考查氧化还原反应有关计算,为高频考点,明确铁和硝酸反应特点及铁为变价金属是解本题关键,采用极限法分析解答,题目难度不大.

练习册系列答案
相关题目
4.下列说法错误的是( )
| A. | 三硝基甲苯的分子式为C7H3N3O6 | |
| B. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 | |
| C. |  在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 在核磁共振氢谱中能出现两个峰,且其峰面积之比为3:1 | |
| D. | 2,3-二甲基丁烷的核磁共振氢谱中会出现两个峰 |
1.在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=“-92.4“kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡向左移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
8.下列关于摩尔的说法中,正确的是( )
| A. | 摩尔是表示物质质量的单位 | |
| B. | 摩尔是国际七个基本物理量之一 | |
| C. | 摩尔既是物质的量的单位,又是粒子的数量单位 | |
| D. | 用物质的量时,要指明粒子种类 |
18.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在下列横线上填写“大于”、“小于”、“等于”.
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为: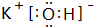 .
.
(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为:
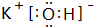 .
.(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
5.下列有关有机物的说法正确的是( )
| A. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 | |
| B. | 淀粉和纤维素的化学式都是(C6H10O5)n,因此它们互为同分异构体 | |
| C. | 分馏煤焦油可以得到苯和甲苯,说明煤中含有苯和甲苯等芳香烃 | |
| D. | 乙烯、苯、四氯化碳分子中所有原子都在同一平面上 |
3.铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康.不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍.下列叙述错误的是( )
| A. | 在反应Cr2O72-+I一+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3:2 | |
| B. | 一般情况下污水中的Cr3+在溶解的氧气的作用下易被氧化为Cr2O72- | |
| C. | K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶 | |
| D. | 维生素C具有还原性,发生铬中毒时,可服用维生素C缓解毒性 |