��Ŀ����
8������ͼʾ�У�A��C�������г��õ����ֽ������������ʾ�Ϊ������һ�����B�Ǻ���ɫ��ĩ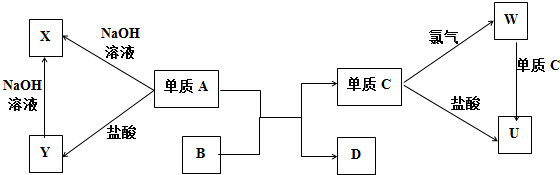
��ش�
��1�����A��Ԫ�������ڱ��е�λ���ǵ������ڵڢ�A�壮
��2��Y��X������Ӧ�����ӷ���ʽΪAl3++4OH-=AlO2-+2H2O��W��U������Ӧ�����ӷ���ʽΪ2Fe3++Fe=3Fe2+����
��3��U����Һ�м���NaOH��Һ���ڿ����з���һ��ʱ�䣬�۲쵽�˹����е��������а�ɫ�������֣���ɫ����Ѹ�ٱ�Ϊ����ɫ����Ϊ���ɫ��
��4������˵������ȷ����abc������ţ���
a����ҵ�п��õ������������ķ���ұ������A
b����ͬ���ʵ����ĵ���A��������ᡢNaOH��Һ��Ӧ���ɵ�����������
c��������KSCN��Һ���黯����W��Һ�еĽ��������ӣ�
���� A��C�������г��õ����ֽ������������ʾ�Ϊ������һ�����B�Ǻ���ɫ��ĩ����BΪFe2O3������A��B��Ӧ���ɵ���C��D���÷�ӦӦΪ���ȷ�Ӧ��AΪAl��CΪFe��DΪAl2O3������������Ӧ����WΪFeCl3���������ᷴӦ����UΪFeCl2�������������Ʒ�Ӧ����XΪNaAlO2���������ᷴӦ����YΪAlCl3���Ȼ�����������������Ʒ�Ӧ����ƫ�����ƣ��Ȼ���������Ӧ�����Ȼ����������ϸ����ʵ�ת����ϵ���ݴ˴��⣮
��� �⣺A��C�������г��õ����ֽ������������ʾ�Ϊ������һ�����B�Ǻ���ɫ��ĩ����BΪFe2O3������A��B��Ӧ���ɵ���C��D���÷�ӦӦΪ���ȷ�Ӧ��AΪAl��CΪFe��DΪAl2O3������������Ӧ����WΪFeCl3���������ᷴӦ����UΪFeCl2�������������Ʒ�Ӧ����XΪNaAlO2���������ᷴӦ����YΪAlCl3���Ȼ�����������������Ʒ�Ӧ����ƫ�����ƣ��Ȼ���������Ӧ�����Ȼ����������ϸ����ʵ�ת����ϵ��
��1��AΪAl����Ԫ�������ڱ��е�λ���ǵ������ڵڢ�A�壬�ʴ�Ϊ���������ڵڢ�A�壻
��2���Ȼ�����������������Ʒ�Ӧ����ƫ�����ƣ���Ӧ�����ӷ���ʽΪ Al3++4OH-=AlO2-+2H2O���Ȼ���������Ӧ�����Ȼ���������Ӧ�����ӷ���ʽΪ 2Fe3++Fe=3Fe2+��
�ʴ�Ϊ��Al3++4OH-=AlO2-+2H2O�� 2Fe3++Fe=3Fe2+��
��3���Ȼ���������Һ�м���NaOH��Һ���ɰ�ɫ���������������ڿ����з���һ��ʱ�䣬�۲쵽���������а�ɫ�������֣���ɫ����Ѹ�ٱ�Ϊ����ɫ����Ϊ���ɫ��
�ʴ�Ϊ���а�ɫ�������֣���ɫ����Ѹ�ٱ�Ϊ����ɫ����Ϊ���ɫ��
��4��a����ҵ�п��õ�������������ķ���ұ������������a��ȷ��
b�����ݵ��ӵ�ʧ�غ��֪����ͬ���ʵ���������������ᡢNaOH��Һ��Ӧ���ɵ�������������ȣ���b��ȷ��
c��WΪFeCl3��������KSCN��Һ���������ӣ���c��ȷ��
��ѡabc��
���� ���⿼�������ƶϣ����ʵ���ɫ����;�����ȷ�ӦΪ�ƶ�ͻ�ƿڣ���Ҫѧ����������Ԫ�ػ�����֪ʶ���Ѷ��еȣ�

| A�� | 0.3 mol/L Na2SO4��Һ�к���Na+��SO42-�����ʵ���Ϊ0.9mol | |
| B�� | ��1Lˮ����22.4LNH3ʱ���ð�ˮ��Ũ�Ȳ���1 mol/L��ֻ�е�22.4L NH3����ˮ�Ƶ�1L��ˮʱ����Ũ�Ȳ���1 mol/L | |
| C�� | 10��ʱ0.5 mol/L��ϡ����100mL��������5gˮ����ȴ��10��ʱ�������С��100mL���������ʵ���Ũ�ȴ���0.5 mol/L | |
| D�� | 10��ʱ0.5 mol/L��KCl������Һ100mL��������5gˮ����ȴ��10��ʱ�������С��100 mL���������ʵ���Ũ����Ϊ0.5 mol/L |
| A�� | ��5����2����1����3����4�� | B�� | ��5����2����3����1����4�� | C�� | ��4����2����1����3����5�� | D�� | ��4����2����1����5����3�� |
| A�� | n��Cl2����n��Fe��=5��4 5Cl2+4Fe $\frac{\underline{\;��ȼ\;}}{\;}$2FeCl2+2FeCl3 | |
| B�� | n��Cl2����n��FeBr2��=1��1 Fe2++2Br-+Cl2�TFe3++Br2+2Cl- | |
| C�� | n��MnO4-����n��H2O2��=2��3 2MnO4-+3H2O2+6H+�T2Mn2++4O2��+6H2O | |
| D�� | n��Fe����n[HNO3��ϡ��]=1��3 4Fe+12H++3NO3-�T3Fe2++Fe3++3NO��+6H2O |
| A�� | �Ȼ�����Һ�м��������ˮ��Al3++4NH3•H2O�T[Al��OH��4]-+4NH4+ | |
| B�� | ����ʯ��ˮ������մ���Һ��Ӧ��Ca2++HCO3-+OH-�TCaCO3��+H2O | |
| C�� | ̼������ڴ��CaCO3+2H+�TCa2++CO2��+H2O | |
| D�� | �⻯������ͨ��������2I-+Cl2�TI2+2Cl- |
 ��
��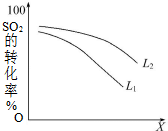 һ���¶��£���2L�ܱ������з�����Ӧ��2SO2��g��+O2��g��?2SO3��g����H=-196kJ•mol-1
һ���¶��£���2L�ܱ������з�����Ӧ��2SO2��g��+O2��g��?2SO3��g����H=-196kJ•mol-1