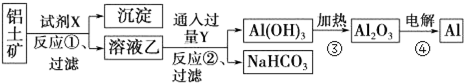
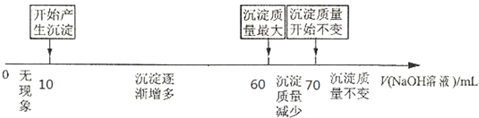
题目内容
9.解释下列实验事实的离子方程式正确的是( )| A. | 向稀Fe(NO3)2和NaBr混合溶液加入少量稀盐酸:6Br-+8H++2NO${\;}_{3}^{-}$═3Br2+2NO↑+4H2O | |
| B. | 往NH4Al(SO4)2溶液中滴加Ba(OH)2溶液加热,刚好使NH4+全部转化为NH3:NH4++Al3++SO42-+Ba2+4OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Al(OH)3↓+BaSO4+H2O | |
| C. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| D. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O |
分析 A.亚铁离子还原性大于溴离子,加盐酸时,只有亚铁离子发生氧化还原反应;
B.刚好使NH4+全部转化为NH3,以1:2反应;
C.水解分步进行,以第一步水解为主;
D.反应生成偏铝酸钠和水.
解答 解:A.向稀Fe(NO3)2和NaBr混合溶液加入少量稀盐酸的离子反应为4H++NO3-+3Fe2+═NO↑+2H2O+3Fe3+,故A错误;
B.往NH4Al(SO4)2溶液中滴加Ba(OH)2溶液加热,刚好使NH4+全部转化为NH3的离子反应为NH4++Al3++2SO42-+2Ba2+4OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Al(OH)3↓+2BaSO4+H2O,故B错误;
C.碳酸钠溶液呈碱性的离子反应为CO32-+H2O?HCO3-+OH-,故C错误;
D.用氢氧化钠溶液去除铝条表面的氧化膜的离子反应为Al2O3+2OH-═2AlO2-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
3.下列关于铅蓄电池的说法正确的是( )
| A. | 放电时,电池的负极质量减轻 | |
| B. | 放电时,正极周围的pH升高 | |
| C. | 充电时,电池中硫酸的浓度不断减小 | |
| D. | 充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
4.下列分子中的14个碳原子一定会处于同一平面上的是( )
| A. |  | B. |  | C. |  | D. |  |
17.下列检测方法不合理的是( )
| 实验 | 检验方法 | |
| A | 向沸水中滴加饱和FeCl3溶液,制备胶体 | 用可见光束照射 |
| B | 确认铜与浓硫酸反应生成CuSO4 | 将反应后溶液转入盛有水的烧杯中 |
| C | 区分AgNO3溶液和Al2(SO4)3溶液 | 分别取少量溶液,滴加BaCl2溶液 |
| D | 证明氯水中起漂白作用的不是Cl2 | 用CCl4充分萃取,将红纸条分别浸入分层后的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
4.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2.

实验操作和现象:
(1)现象i 中的白雾是HCl小液滴,形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl 气体,同时受热失去结晶水,HCl和H2O 结合形成盐酸小液滴.
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
方案1B中溶液变为蓝色
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | iA中部分固体溶解,上方出现白雾 ii稍后,产生黄色气体,管壁附着黄色液滴 iiiB中溶液变蓝 |
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液检验现象ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象ii 中黄色气体含有FeCl3.
(3)除了氯气可使B 中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI-淀粉溶液,再滴入几滴HCl 溶液,在空气中放置,观察一段时间后溶液是否变蓝.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,无证实了Cl2的存在.
方案 1:在A、B 间增加盛有某种试剂的洗气瓶C.
方案 2:将B 中KI-淀粉溶液替换为NaBr 溶液;检验 Fe 2+.
现象如下:
| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈浅橙色;未检出Fe2+ |
方案2B中溶液呈浅橙红色;未检出Fe 2+
①方案1 的C 中盛放的试剂是饱和NaCl 溶液.
②方案2 中检验 Fe 2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
③综合方案1、2 的现象,说明选择NaBr 溶液的依据是Br-可以被Cl2 氧化成Br2,但不会被Fe3+氧化为Br2.
(5)将A 中产物分离得到Fe2O3和MnCl2,A 中产生Cl2的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
14.已知反应:①Cl2+2KBr═2KCI+Br2 ②KClO3+6HCl═3Cl2+KCl+3H2O ③2KBrO3+Cl2=═Br2+2KClO3,下列说法正确的是( )
| A. | 上述三个反应都有单质生成.都属于置换反应 | |
| B. | 氧化性KClO>Br,还原性Br->CI- | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中2mol还原剂反应则氧化剂得到电子的物质的量为2mol |
1.已知反应CO(g)+Cl2(g)?COCl2(g)在某温度恒容条件下进行,反应开始时c(CO)=0.0350mol•L-1,c(Cl2)=0.0270mol•L-1,c(COCl2)=0.011 mol•L-1,达到平衡时,C(COCl2)=0.032mol•L-1.该条件下氯气的转化率是( )
| A. | 60% | B. | 77.8% | C. | 48.0% | D. | 34.4% |
18.下列物质的水溶液因水解而呈碱性的是( )
| A. | NaCl | B. | NH4Cl | C. | Na2CO3 | D. | NaOH |