题目内容
下列根据反应原理设计的应用,不正确的是
A.CO32-+H2O HCO3-+OH- 热的纯碱溶液清洗油污 HCO3-+OH- 热的纯碱溶液清洗油污 |
B.Al3++3H2O Al(OH)3(胶体)+3H+ 明矾净水 Al(OH)3(胶体)+3H+ 明矾净水 |
| C.Al3++3HCO3-=Al(OH)3↓+3CO2↑ 泡沫灭火器灭火 |
| D.SnCl2+H2O=Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |
D
解析试题分析:A、水解是吸热的,加热促进水解,所以根据水解方程式CO32-+H2O HCO3-+OH-可知,热的纯碱溶液更有利于清洗油污,A正确;B、明矾溶于水电离出的Al3+水解生成氢氧化铁胶体,胶体具有吸附性可以使水中的悬浮物沉淀下来,因此明矾可以作为净水剂,B正确;C、Al3+与HCO3-水解相互促进生成氢氧化铝和CO2,所以泡沫灭火器可用来灭火,C正确;D、Sn2+水解溶液显酸性,因此配制氯化亚锡溶液时应加入盐酸以及抑制Sn2+水解,加入氢氧化钠促进Sn2+水解,D不正确,答案选D。
HCO3-+OH-可知,热的纯碱溶液更有利于清洗油污,A正确;B、明矾溶于水电离出的Al3+水解生成氢氧化铁胶体,胶体具有吸附性可以使水中的悬浮物沉淀下来,因此明矾可以作为净水剂,B正确;C、Al3+与HCO3-水解相互促进生成氢氧化铝和CO2,所以泡沫灭火器可用来灭火,C正确;D、Sn2+水解溶液显酸性,因此配制氯化亚锡溶液时应加入盐酸以及抑制Sn2+水解,加入氢氧化钠促进Sn2+水解,D不正确,答案选D。
考点:考查水解平衡的有关应用与判断

练习册系列答案
相关题目
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A. | B. | C.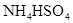 | D. |
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(H+)=c(OH—)+c(NH3·H2O) |
| D.①和③等体积混合后的溶液:c(NH4+)>c(Cl—)>c(OH—)>c(H+) |
100mL 0.2 mol/L NH4Cl溶液,测其pH为a。加蒸馏水稀释至1L后,溶液有关变化错误的是
| A.c(NH4Cl)变为0.02mol/L | B.水的电离程度变大 |
| C.n(Cl-)无变化 | D.pH小于a+1 |
室温下,在0.01mol/L的Na2CO3溶液中,水的离子积常数(KW)为
| A.1×10—14 | B.大于1×10—14 | C.小于1×10—14 | D.无法确定 |
室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
| A.加适量的醋酸钠晶体后,两溶液的pH均增大 |
| B.使温度都升高20℃后,两溶液的pH均不变 |
| C.加水稀释2倍后,两溶液的pH均减小 |
| D.加足量的锌充分反应后,两溶液产生的氢气一样多 |
关于浓度相等的三种溶液:①H2CO3;②NaOH;③Na2CO3溶液,下列说法正确的是:
| A.水电离出的c(H+):③>①>② |
| B.溶液的pH:③>②>① |
| C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
| D.①和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)? c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3