题目内容
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子的电子总数大4,1 mol A的单质跟足量盐酸反应可置换出11.2L(标准状况)氢气,这时A变成与氖原子具有相同电子层结构的离子.试回答:
(1)写出各元素的名称:A_______,B_______,C_______.
(2)分别写出A、B最高价氧化物对应水化物,分别跟C的气态氢化物水溶液反应的离子方程式_______,________.
(3)A离子的氧化性比B离子的氧化性_______(填“强”或“弱”),其原因是________.
答案:略
解析:
解析:
|
(1) 钠 铝 氯 (2)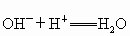 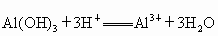 (3)弱 钠比铝金属性强易失电子,失去电子变成阳离子后 (3)弱 钠比铝金属性强易失电子,失去电子变成阳离子后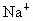 比 比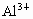 难得电子,即氧化性要弱 难得电子,即氧化性要弱
解析:根据 1 mol A的单质跟足量盐酸反应可生成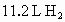 ,可知A的阳离子为+1价,故A应为Na元素,B的核电荷数应为13,铝元素,C的原子序数应为17,氯元素. ,可知A的阳离子为+1价,故A应为Na元素,B的核电荷数应为13,铝元素,C的原子序数应为17,氯元素. |

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目

 如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)
如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)