题目内容
(1)1.204×1024个水分子,用物质的量来表示,为 molH2O.
(2)5mol的CO2与8mol的H2的分子数比是 ;原子数比是
(3)在标准状况下,2molCO2的体积为 L,质量 g.
(4)在400mL2mol?L-1H2SO4溶液中,溶质的质量是 .此溶液中H+的物质的量浓度为 ,SO42-的物质的量浓度为 .
(2)5mol的CO2与8mol的H2的分子数比是
(3)在标准状况下,2molCO2的体积为
(4)在400mL2mol?L-1H2SO4溶液中,溶质的质量是
考点:物质的量的相关计算
专题:计算题
分析:根据n=
=
=
=cV结合物质的构成计算.
| N |
| NA |
| V |
| Vm |
| m |
| M |
解答:
解:(1)n(H2O)=
=2mol,故答案为:2;
(2)由n=
可知,物质的量之比等于分子数之比,5mol的CO2与8mol的H2的分子数比是5:8,原子数之比为5×3:8×2=15:16,
故答案为:5:8;15:16;
(3)V(CO2)=2mol×22.4L/mol=44.8L,m(CO2)=2mol×44g/mol=88g,
故答案为:44.8L;88g;
(4)在400mL2mol?L-1H2SO4溶液中,n(H2SO4)=0.4L×2mol/L=0.8mol,m(H2SO4)=0.8mol×98g/mol=78.4g,c(H+)=2c(H2SO4)=4mol/L,c(SO42-)=c(H2SO4)=2mol/L,
故答案为:78.4g;4mol/L;2mol/L.
| 1.204×1024 |
| 6.02×1023/mol |
(2)由n=
| N |
| NA |
故答案为:5:8;15:16;
(3)V(CO2)=2mol×22.4L/mol=44.8L,m(CO2)=2mol×44g/mol=88g,
故答案为:44.8L;88g;
(4)在400mL2mol?L-1H2SO4溶液中,n(H2SO4)=0.4L×2mol/L=0.8mol,m(H2SO4)=0.8mol×98g/mol=78.4g,c(H+)=2c(H2SO4)=4mol/L,c(SO42-)=c(H2SO4)=2mol/L,
故答案为:78.4g;4mol/L;2mol/L.
点评:本题综合考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及物质的构成特点,难度不大.

练习册系列答案
相关题目
下列各组离子因为生成难溶物而不能大量共存的是( )
| A、Cl-、Fe3+、NO3-、OH- |
| B、HCO3-、Cl-、Na+、H+ |
| C、Ba2+、Cl-、NO3-、K+ |
| D、NH4+、K+、OH-、Cl- |
以下实验原理或操作中,正确的是( )
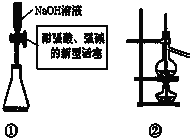

| A、装置①量取15.00 mLNaOH溶液 |
| B、装置②既可用于乙醇制乙烯的发生装置,又可用于分离沸点相差较大的互溶液体混合物 |
| C、室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色 |
| D、纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
分析下表中各项的排布规律,有机物X是按此规律排布的第19项,下列有关X的结构和性质说法中一定错误的是
( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、是戊酸,同分异构体有4种 |
| B、是酯,在稀硫酸条件下水解的两种产物的相对分子质量不可能相等 |
| C、可以发生银镜反应 |
| D、可以与溴水发生加成反应 |
下列关于有机物的说法中,正确的是( )
A、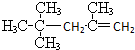 的名称为2,2,4-三甲基戊烯 的名称为2,2,4-三甲基戊烯 |
B、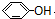 、 、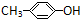 和 和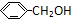 互为同系物 互为同系物 |
| C、CH≡CCH2CH3的所有碳原子在一条直线上 |
D、HCHO和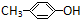 在一定条件下能发生缩聚反应生成 在一定条件下能发生缩聚反应生成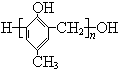 |
下列由相关实验现象所推出的结论正确的是( )
| A、向氯水中加入有色布条,片刻后有色布条褪色,说明有Cl2存在 |
| B、向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C、Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |

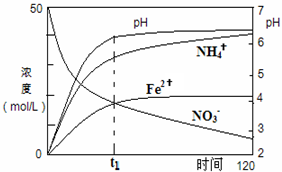 氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.