题目内容
16.(双选)关于氧化还原反应的下列说法中正确的是( )| A. | 氧化还原反应前后元素化合价有升降 | |
| B. | 氧化还原反应前后一定有氧的得失 | |
| C. | 氧化还原反应前后一定有电子转移 | |
| D. | 复分解反应和化合反应一定是氧化还原反应 |
分析 氧化还原反应的实质为电子转移,特征为化合价的变化,复分解反应中一定没有元素的化合价变化,而某些化合反应中有元素的化合价变化,以此来解答.
解答 解:A.氧化还原反应前后元素化合价有升降,且升降总数相等,故A正确;
B.氧化还原反应不一定有氧参加,如氢气、氯气反应生成HCl中没有氧参加,故B错误;
C.氧化还原反应的实质为电子转移,则氧化还原反应前后一定有电子转移,故C正确;
D.复分解反应为非氧化还原反应,而某些化合反应为氧化还原反应,如C与氧气反应为氧化还原反应,故D错误;
故选AC.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应实质与特征的考查,题目难度不大.

练习册系列答案
相关题目
7.如表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
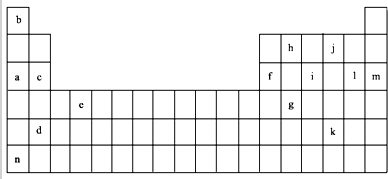
(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量Li原子失去1个电子后形成稳定结构,再失去1个电子很困难.
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式 .
.
(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.

(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式
 .
.(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.
7.Na2O和Na2O2的下列叙述中正确的是( )
| A. | Na2O比Na2O2稳定 | B. | 均可与水反应生成氧气 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
4.下面实验操作可以实现实验目的是(填序号) ( )
| A. | 用铝块与氧化铁粉末充分混和进行铝热反应 | |
| B. | 取少量蔗糖溶液加稀硫酸水浴加热几分钟后加新制的氢氧化铜浊液加热,观察现象,判断蔗糖水解的产物中是否含有葡萄糖 | |
| C. | 用稀硝酸清洗做过银镜反应实验的试管 | |
| D. | 在苯中加入溴水,充分振荡静置,观察现象,判断苯环中的碳碳键是否存在碳碳双键 |
11.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| C. | 常温下,等物质的量浓度的三种溶液:①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2中c(NH4+):①<③<② | |
| D. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
1.下列说法正确的是( )
| A. | 水的电离方程式:H2O═H++OH- | B. | 升高温度,水的电离程度增大 | ||
| C. | 在NaOH溶液中没有H+ | D. | 在HCl溶液中没有OH- |
8.下列说法中一定正确的是( )
| A. | pH=7的溶液中性 | B. | pH>7,溶液呈碱性 | ||
| C. | pH=6溶液中[OH-]=1×10-8 mol•L-1 | D. | pH=6溶液中[H+]=1×10-6 mol•L-1 |
5.如表有三组物质,每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液).
根据该表回答问题:
(1)第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
(2)不跟第I组所有物质发生反应的,能跟第Ⅲ组中所有物质发生反应的是第II组物质中的NaOH,其化学反应方程式为2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3、2NaOH+H2SO4=Na2SO4+2H2O、2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | Fe | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Zn | NaOH | MgCl2 |
(1)第Ⅲ组中有一种物质能与第Ⅰ组中的所有物质反应,这种物质是H2SO4.
(2)不跟第I组所有物质发生反应的,能跟第Ⅲ组中所有物质发生反应的是第II组物质中的NaOH,其化学反应方程式为2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3、2NaOH+H2SO4=Na2SO4+2H2O、2NaOH+MgCl2=Mg(OH)2↓+2NaCl.
6.往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生.下列说法不正确的是( )
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO4 | ||
| C. | 该实验表明FeCl3有氧化性 | D. | 反应后溶液酸性增强 |