题目内容
10.以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中正极上的电极反应式是O2+2H2O+4e-=4OH-,负极区的pH减小(填“增大”、“减小”、“不变”).分析 甲醇、空气和KOH溶液为原料而石墨为电极构成燃料电池,通入燃料的电极是负极、通入空气的电极是正极,正极上氧气得电子和水反应生成氢氧根离子,负极上甲醇失电子和氢氧根离子反应生成水,据此分析解答.
解答 解:甲醇、空气和KOH溶液为原料而石墨为电极构成燃料电池,通入燃料的电极是负极、通入空气的电极是正极,正极上氧气得电子和水反应生成氢氧根离子,正极反应式为O2+2H2O+4e-=4OH-,负极上甲醇失电子和氢氧根离子反应生成水,则负极附近溶液的pH减小,故答案为:O2+2H2O+4e-=4OH-;减小.
点评 本题考查电极反应式的书写,为高频考点,明确原电池原理及各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意:碱性电池中不能生成氢离子.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.在m g 浓度为c mol•L-1,密度为ρ g/cm3的浓硫酸中加入一定量的水,稀释成浓度为c/2mol•L-1的硫酸,则加入水的体积为( )
| A. | 小于m mL | B. | 等于m mL | C. | 大于m mL | D. | 无法确定 |
1.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 常温常压下,17g NH3所含有的原子的数目为4NA | |
| B. | 标准状况下,22.4LCCl4所含分子数为NA | |
| C. | 铝与足量盐酸反应,生成2.24LH2时,转移的电子数为0.2 NA | |
| D. | 0.1 mol/L的Na2CO3溶液中含有Na+的数目是0.2 NA |
18.下列有关化学用语表达不正确的是( )
| A. | 氮气的电子式: | B. | 次氯酸分子的结构式:H-O-Cl | ||
| C. | Na的原子结构示意图: | D. | 钙离子的电子式:Ca2+ |
5.下面有关13C、15N的叙述正确的是( )
| A. | 15N与14N互为同位素 | B. | 13C与C60互为同位素 | ||
| C. | 13C与15N有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
15.五种短周期元素的某些信息如表所示:
下列说法正确的是( )
| 元素 | 有关信息 |
| X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| Y | M层上有3个电子 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 其单质是淡黄色固体 |
| Q | 最高正价与最低负价代数和为6 |
| A. | 简单离子的半径大小顺序为:W>Q>Z>Y | |
| B. | W单质在氧气中燃烧后的产物不能使品红溶液褪色 | |
| C. | X、W和氢三种元素形成的化合物中只有共价键 | |
| D. | Z与W元素只能形成原子个数比为2:1的化合物 |
19.下列操作不能实现实验目的是( )
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 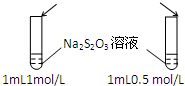 | 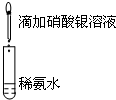 |
| C.目的:比较Al、Fe、Cu活动性 | D.目的:实验室制取氨气 |
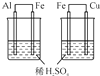 |  |
| A. | A | B. | B | C. | C | D. | D |
20. 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).
据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是CH4•nH2O=CH4↑+nH2O.
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4 kJ•mol-1.
②CH4不完全燃烧也可制得合成气:CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g);
△H=-35.4kJ•mol-1.则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为②(填序号);原因是选择CH4不完全燃烧,制合成气体时,放出热量,同时得到CO:H2为1:2,能恰好完全反应合成甲醇.
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
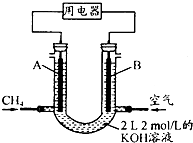
(4)可燃冰中CH4的其它用途是,将CH4设计成燃料电池,其利用率更高,装置示意图(A、B为多孔性碳棒).持续通人甲烷,在标准状况下,消耗甲烷体积VL.
①O<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O,
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-.
 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).
据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是CH4•nH2O=CH4↑+nH2O.
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
①在101KPa时,1.6g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64kJ.则甲烷与H2O(g)反应的热化学方程式:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4 kJ•mol-1.
②CH4不完全燃烧也可制得合成气:CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g);
△H=-35.4kJ•mol-1.则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为②(填序号);原因是选择CH4不完全燃烧,制合成气体时,放出热量,同时得到CO:H2为1:2,能恰好完全反应合成甲醇.
(3)利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)=CH3OH(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)=CO(g)+H2O(g)△H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
(4)可燃冰中CH4的其它用途是,将CH4设计成燃料电池,其利用率更高,装置示意图(A、B为多孔性碳棒).持续通人甲烷,在标准状况下,消耗甲烷体积VL.
①O<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O,
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-.
 ,
, .
.