题目内容
12.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )| A. | X与Y形成的化合物中,X可以显负价,Y显正价 | |
| B. | 最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性 | |
| C. | 第一电离能X一定大于Y | |
| D. | 气态氢化物的稳定性:HmY小于HnX |
分析 X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.电负性大的元素在化合物中显负价;
B.非金属性越强,其最高价氧化物的水化物的酸性越强,但O、F除外;
C.一般非金属性强的,其第一电离能大;
D.非金属性越强,气态氢化物越稳定.
解答 解:X、Y元素同周期,且电负性X>Y,则非金属性X>Y.
A.电负性大的元素在化合物中显负价,所以X和Y形成化合物时,X显负价,Y显正价,故A正确;
B.非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性X>Y,则X对应的酸性强于Y对应的酸的酸性,故B正确;
C.一般非金属性强的第一电离能大,但特殊O的非金属性比N大,但第一电离能N>O,故C错误;
D.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性:HmY小于HnX,故D正确.
故选C.
点评 本题考查位置、结构、性质,为高频考点,侧重于学生的分析能力的考查,明确同周期位置关系及电负性大小得出元素的非金属性是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
2.科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | W g该原子中含有aNA该原子 | |
| B. | 由已知信息可得:NA=$\frac{12}{a}$ | |
| C. | 该原子的摩尔质量是aNA | |
| D. | W g该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol |
7.下列化学用语说法正确的是( )
| A. | 氮原子电子排布图为: | |
| B. | S2-的结构示意图: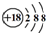 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 氯化钠的电子式: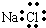 |
4.下列关于苯的叙述正确的是( )
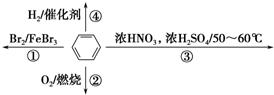

| A. | 反应①为取代反应,有机产物浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并伴有浓烟 | |
| C. | 反应③为取代反应,只生成一种产物 | |
| D. | 反应④中1 mol苯最多与3 mol H2发生加成反应,因为苯分子含有3个碳碳双键 |
1.下列物质中所含分子物质的量最多的是( )
| A. | 44 g CO2 | B. | 1.5 mol H2 | ||
| C. | 标况下22.4L SO2 | D. | 3.01×1023个硫酸分子 |
2.下列关于食盐的说法错误的是( )
| A. | 海水中最丰富的资源是食盐 | |
| B. | 现代社会绝大部分食盐用于食用 | |
| C. | 古代我国就在海滩晒盐,这称为盐田法 | |
| D. | 目前我国海盐年产量名列世界第一 |

 .
.
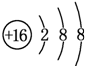 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的电子式为 ,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).