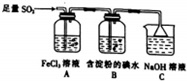
题目内容
11.下列递变规律中,正确的是( )| A. | Na、Mg、Al、S的还原性依次增强 | |
| B. | O、S、Na、K的原子半径依次增大 | |
| C. | H2S、PH3、HCl、HF的热稳定性依次增强 | |
| D. | Mg(OH)2、Al(OH)3、KOH、Ca(OH)2的碱性依次增强 |
分析 A.同周期,从左向右金属性减弱;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小;
C.非金属性越强,氢化物越稳定;
D.金属性越强,对应最高价氧化物水化物的碱性越强.
解答 解:A.同周期,从左向右金属性减弱,则Na、Mg、Al、S的还原性依次减弱,故A错误;
B.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则O、S、Na、K的原子半径依次增大,故B正确;
C.非金属性F>Cl>S>P,PH3、H2S、HCl、HF的热稳定性依次增强,故C错误;
D.金属性K>Ca>Mg>Al,Al(OH)3、Mg(OH)2、Ca(OH)2、KOH的碱性依次增强,故D错误;
故选B.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
1.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的最高价氧化物对应的水化物的化学式C、NaOH,D、Al(OH)3,E、HClO4;
(2)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(3)E单质与C的氧化物对应水化物溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
(4)A单质在E单质中燃烧的反应现象是安静的燃烧,苍白色火焰,产生白雾.
2.下列化学用语表示正确的是( )
| A. | 甲烷的比例模型: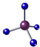 | B. | O2与O22-互为同分异构体 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 | D. | S2-的结构示意图: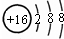 |
19.下列所述的两者是同种物质的是( )
| A. | HCl和盐酸 | B. | 干冰和CO2 | C. | 正丁烷和异丁烷 | D. | 白磷和红磷 |
6.表是几种常用燃料的燃烧热:1mol燃料完全燃烧(生成物中的H2O为液态)时放出的热量.
(1)从热量角度分析,目前最适合家庭使用的优质气体燃料是甲烷.
(2)写出乙醇完全燃烧的热化学方程式C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.
| 物质 | 炭粉 | 一氧化碳 | 氢气 | 甲烷 | 乙醇 |
| 状态 | 固体 | 气体 | 气体 | 气体 | 液体 |
| 热量(kJ) | 392.8 | 282.6 | 285.8 | 890.3 | 1367 |
(2)写出乙醇完全燃烧的热化学方程式C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367KJ/mol.
16.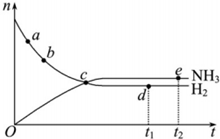 对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | a点、b点的正反应速率比逆反应速率大 | |
| B. | c点时每断裂3molH-H则断裂6molN-H | |
| C. | d点(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | v(N2):V (NH3)=1:2时达到平衡 |
20.下列各组化合物中,所含化学键类型完全相同的是( )
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |
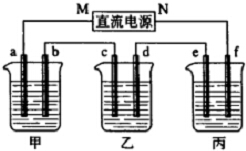 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放硫酸铜溶液、饱和氯化钠溶液(滴有少许酚酞)和100g10.00%的Na2SO4溶液.