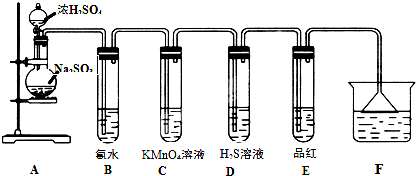
题目内容
在SO2+Cl2+2H2O=H2SO4+2HCl反应中,氧化剂是
Cl2
Cl2
,还原剂是SO2
SO2
;被氧化的元素是S
S
,被还原的元素是Cl
Cl
.若有6.4gSO2完全反应,转移电子的物质的量为0.2mol
0.2mol
.分析:含元素化合价升高的物质为还原剂,该元素在反应中被氧化;含元素化合价降低的物质为氧化剂,该元素在反应中被还原;根据S元素的化合价变化来计算转移电子的物质的量.
解答:解:在SO2+Cl2+2H2O=H2SO4+2HCl反应中,
S元素的化合价由+4价升高为+6价,
Cl元素的化合价由0降低为-1价,
则SO2为还原剂,S元素被氧化,
Cl2为氧化剂,Cl元素被还原;
又6.4gSO2的物质的量为
=0.1mol,
则该反应中转移的电子为0.1mol×(6-4)=0.2mol,
故答案为:Cl2;SO2;S;Cl;0.2mol.
S元素的化合价由+4价升高为+6价,
Cl元素的化合价由0降低为-1价,
则SO2为还原剂,S元素被氧化,
Cl2为氧化剂,Cl元素被还原;
又6.4gSO2的物质的量为
| 6.4g |
| 64g/mol |
则该反应中转移的电子为0.1mol×(6-4)=0.2mol,
故答案为:Cl2;SO2;S;Cl;0.2mol.
点评:本题考查氧化还原反应,明确反应中的基本概念,并学会利用元素的化合价来分析氧化剂、还原剂、计算转移的电子数,难度不大.

练习册系列答案
相关题目


 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-