题目内容
【题目】三氯化磷![]() 是一种重要的有机合成催化剂。实验室常用红磷与干燥的
是一种重要的有机合成催化剂。实验室常用红磷与干燥的![]() 制取
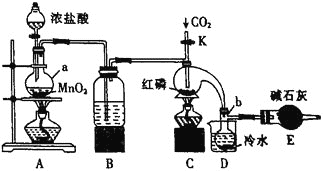
制取![]() ,装置如图所示。
,装置如图所示。
已知:![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,易被氧化,遇水易水解,与
,易被氧化,遇水易水解,与![]() 反应生成
反应生成![]() 。
。
请回答下列问题:
(1)装置A中发生反应的化学方程式为___________。
(2)仪器b的名称是___________,装置B中所装试剂名称是___________,装置E中碱石灰的作用是___________。
(3)实验时,检查装置气密性后,向装置C的曲颈瓶中加入红磷,打开止水夹K通入干燥的![]() ,一段时间后,关闭K,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通入干燥
,一段时间后,关闭K,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通入干燥![]() 的作用是___________。
的作用是___________。![]() 不能用
不能用![]() 代替,理由是___________。
代替,理由是___________。
(4)装置D的作用是___________。
(5)![]() 水解得到亚磷酸
水解得到亚磷酸![]() ,二元弱酸
,二元弱酸![]() ,写出亚磷酸钠被浓硝酸氧化的离子方程式:___________。
,写出亚磷酸钠被浓硝酸氧化的离子方程式:___________。
(6)经分析,![]() 产品中含有少量
产品中含有少量![]() ,某同学设计如下实验测定
,某同学设计如下实验测定![]() 的纯度:取
的纯度:取![]() 产品于锥形瓶中,加入过量稀硝酸,振荡充分反应,然后加入足量的硝酸银溶液,完全反应后过滤,滤渣经干燥后称量得
产品于锥形瓶中,加入过量稀硝酸,振荡充分反应,然后加入足量的硝酸银溶液,完全反应后过滤,滤渣经干燥后称量得![]() 。则该产品中
。则该产品中![]() 的质量分数为___________
的质量分数为___________![]() 保留两位有效数字
保留两位有效数字![]() 。
。
【答案】4HCl+MnO2![]() 2H2O+MnCl2+Cl2↑ 蒸馏烧瓶 浓硫酸 吸收
2H2O+MnCl2+Cl2↑ 蒸馏烧瓶 浓硫酸 吸收![]() 、HCl,防止污染空气,同时防止空气中的水蒸气进入装置D中而使
、HCl,防止污染空气,同时防止空气中的水蒸气进入装置D中而使![]() 水解 排除装置C、D中的氧气和水蒸气 防止
水解 排除装置C、D中的氧气和水蒸气 防止![]() 过量生成
过量生成![]() 冷凝收集
冷凝收集![]()
![]()
![]()
【解析】
实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5C,利用D装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用E装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应;
(1)A装置中二氧化锰和浓盐酸反应制取氯气,结合电子守恒和原子守恒写出发生反应的化学方程式;
(2)氯气为酸性气体,需用酸性干燥剂干燥,含有氯气的尾气对环境有污染,碱石灰能吸收酸性气体和水蒸气,D中收集的PCl3易水解;
(3)防止PCl3与O2等发生副反应,通入二氧化碳赶净空气,另外PCl3能与Cl2反应生成PCl5,;
(4)三氯化磷沸点低,可用冷水冷凝收集;
(5)亚磷酸钠遇浓硝酸应被氧化为H3PO4(中强酸),同时硝酸被还原为NO2,结合电子守恒、电荷守恒和原子守恒写出发生反应的离子方程式;
(6)利用氯原子守恒列方程计算![]() 的量,再计算
的量,再计算![]() 的百分含量。
的百分含量。
(1)装置A是制备氯气的装置,发生反应的化学方程式为:4HCl+MnO2![]() 2H2O+MnCl2+Cl2↑;
2H2O+MnCl2+Cl2↑;
(2)仪器b的名称是蒸馏烧瓶;装置B是干燥装置,吸收氯气中的水蒸气,盛装的应为浓硫酸;由已知信息可知![]() 遇水易水解,则装置E中碱石灰的作用一方面是防止空气中的水蒸气进入;另一方面氯气和HCl不能与红磷完全反应,则碱石灰还可以吸收
遇水易水解,则装置E中碱石灰的作用一方面是防止空气中的水蒸气进入;另一方面氯气和HCl不能与红磷完全反应,则碱石灰还可以吸收![]() 、HCl,防止污染空气;
、HCl,防止污染空气;
(3)通入干燥![]() 的作用是排除装置C、D中的氧气和水蒸气,防止影响P和氯气的反应; 已知
的作用是排除装置C、D中的氧气和水蒸气,防止影响P和氯气的反应; 已知![]() 与
与![]() 反应生成
反应生成![]() ,则
,则![]() 不能用
不能用![]() 代替,否则装置内氯气过量可能生成
代替,否则装置内氯气过量可能生成![]() ;
;
(4)已知:![]() 的熔点为
的熔点为![]() ,沸点为
,沸点为![]() ,则装置D冷水浴的作用是冷凝收集
,则装置D冷水浴的作用是冷凝收集![]() ;
;
(5)亚磷酸钠被浓硝酸氧化生成磷酸,浓硝酸被还原为![]() ,反应的离子方程式为:
,反应的离子方程式为:![]() ;
;
(6)![]() 的物质的量为:
的物质的量为:![]() ;说明
;说明![]() 产品中含有的氯元素的总物质的量为
产品中含有的氯元素的总物质的量为![]() ,设其中有xmol
,设其中有xmol ![]() 和
和![]() ,列方程组:
,列方程组:
![]() ,解得:
,解得:![]() ,则
,则![]() ,则
,则![]() 的质量分数为
的质量分数为![]() 。
。