题目内容
 (1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图所示:
(1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图所示:①A,B,C,D,E五点中,尚未达到化学平衡状态的点是
②此可逆反应的正反应是
(2)将N2和H2混和,使其在一定条件下发生反应并达到平衡.根据表中数据回答有关问题:
| 物质 | N2 | H2 | NH3 |
| 起始浓度(摩/升) | a | 6 | 0 |
| 转化浓度(摩/升) | b | c | d |
| 平衡浓度(摩/升) | 1 | e | 3 |
②若反应经3分钟达到平衡,则反应速度v(N2)=
③氮气的转化率是
④该体系的起始状态和平衡状态的压强比(体积、温度不变)是
考点:化学平衡建立的过程,化学平衡的计算
专题:化学平衡专题
分析:(1)①当NH3的体积分数最大时达到平衡状态,AB为氨气增大的阶段,不是平衡状态;DE是升高温度平衡逆移后的平衡状态;
②由C到E可以看出随着温度升高,氨气的百分含量在下降,平衡逆向移动,所以该反应的正反应为放热反应;
(2)利用三段式,
N2 +3H2 ?2NH3
起始(mol/L) 2.5 6 0
转化(mol/L) 1.5 4.5 3
平衡(mol/L) 1 1.5 3
所以①对比表中的相关数据可知a=2.5,e=1.5;
②根据v=
计算反应速率;
③转化率=
×100%,据此计算氮气的转化率;
④压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,据此答题;
②由C到E可以看出随着温度升高,氨气的百分含量在下降,平衡逆向移动,所以该反应的正反应为放热反应;
(2)利用三段式,
N2 +3H2 ?2NH3
起始(mol/L) 2.5 6 0
转化(mol/L) 1.5 4.5 3
平衡(mol/L) 1 1.5 3
所以①对比表中的相关数据可知a=2.5,e=1.5;
②根据v=
| △c |
| t |
③转化率=
| 已转化的浓度 |
| 起始浓度 |
④压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,据此答题;
解答:
解:(1)①当NH3的体积分数最大时达到平衡状态,AB为氨气增大的阶段,不是平衡状态;DE是升高温度平衡逆移后的平衡状态;故AB不是平衡状态,故答案为:AB;
②由C到E可以看出随着温度升高,氨气的百分含量在下降,平衡逆向移动,所以该反应的正反应为放热反应,故答案为:放热;
(2)利用三段式,
N2 +3H2 ?2NH3
起始(mol/L) 2.5 6 0
转化(mol/L) 1.5 4.5 3
平衡(mol/L) 1 1.5 3
所以①对比表中的相关数据可知a=2.5,e=1.5,故答案为2.5;1.5;
②根据v=
可计算出v(N2)=
=0.5mol/(L.min),故答案为:0.5mol/(L.min);
③转化率=
×100%,据此计算氮气的转化率为
×100%=60%,故答案为:60%;
④该体系在起始时总浓度为2.5mol/L+6mol/L=8.5mol/L,平衡后的总浓度为1mol/L+1.5mol/L+3mol/L=5.5mol/L,根据压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,可知起始状态和平衡状态的压强比为8.5:5.5=17:11,故答案为:17:11;
②由C到E可以看出随着温度升高,氨气的百分含量在下降,平衡逆向移动,所以该反应的正反应为放热反应,故答案为:放热;
(2)利用三段式,
N2 +3H2 ?2NH3
起始(mol/L) 2.5 6 0
转化(mol/L) 1.5 4.5 3
平衡(mol/L) 1 1.5 3
所以①对比表中的相关数据可知a=2.5,e=1.5,故答案为2.5;1.5;
②根据v=
| △c |
| t |
| 1.5mol/L |
| 3min |
③转化率=
| 已转化的浓度 |
| 起始浓度 |
| 1.5 |
| 2.5 |
④该体系在起始时总浓度为2.5mol/L+6mol/L=8.5mol/L,平衡后的总浓度为1mol/L+1.5mol/L+3mol/L=5.5mol/L,根据压强之比等于物质的量之比,在体积相等的条件下也等于浓度之比,可知起始状态和平衡状态的压强比为8.5:5.5=17:11,故答案为:17:11;
点评:本题主要考查了平衡状态的判断、反应速率的计算、转化率的计算、阿伏加德罗定律的应用等知识点,中等难度,解题的易错点是对图的识别.

练习册系列答案
相关题目
同体积、同物质的量浓度的KCl、CaCl2、AlCl3三种溶液中Cl-的物质的量浓度之比是( )
| A、3:2:1 |
| B、1:2:3 |
| C、1:1:1 |
| D、2:3:1 |
下列物质分类正确的是( )
①混合物:铝热剂、福尔马林、水玻璃、漂白粉 ②化合物:氯化钙、烧碱、冰水混合物、胆矾 ③酸性氧化物:Mn2O7、N2O3、SiO2、NO2④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨.
①混合物:铝热剂、福尔马林、水玻璃、漂白粉 ②化合物:氯化钙、烧碱、冰水混合物、胆矾 ③酸性氧化物:Mn2O7、N2O3、SiO2、NO2④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同素异形体:C60、C70、金刚石、石墨.
| A、①②④ | B、②③④ |
| C、①②⑤ | D、②④⑤ |
下列灭火实例中,利用了“隔离可燃物”原理的是( )
| A、住宅失火,消防队员用高压水龙头向着火处喷水 |
| B、炒菜时,油锅不慎着火,迅速用锅盖盖灭 |
| C、实验时酒精不慎洒出并燃烧,通常用湿抹布盖灭 |
| D、发生森林火灾时,将火焰蔓延线路前的小片树木砍掉 |
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:
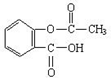 化学是造福人类的科学,在人体保健、医疗卫生等方面作出了重大的贡献.请你用所学的化学知识解答有关问题.
化学是造福人类的科学,在人体保健、医疗卫生等方面作出了重大的贡献.请你用所学的化学知识解答有关问题.