题目内容
9.25℃时,某溶液中水电离的OH-浓度为1×10-5,该溶液可能是( )| A. | NaOH | B. | HCl | C. | NaCl | D. | Na2CO3 |
分析 在25℃时,某稀溶液中由水电离产生的c(H+)=10-5mol/L>10-7mol/L,说明该溶液中水的电离受到促进,则溶液中的溶质为水解的盐,据此分析解答.
解答 解:在25℃时,某稀溶液中由水电离产生的c(H+)=10-5mol/L>10-7mol/L,说明该溶液中水的电离受到促进,则溶液中的溶质为水解的盐,
A.氢氧化钠是碱抑制水的电离,故A错误;
B.HCl是酸抑制水的电离,故B错误;
C.NaCl是强酸强碱盐,温度不变,水的离子积常数不变,水的电离不受影响,故C错误;
D.碳酸钠是强碱弱酸盐,碳酸根离子结合水电离出的氢离子,促进水的电离,故D正确;
故选D.
点评 本题考查弱电解质的电离,根据水的电离程度确定溶液中的溶质,注意水的离子积常数只与温度有关,与溶液酸碱性或浓度无关,为易错点,题目较简单.

练习册系列答案
相关题目
17.“绿色化学”要求在化工合成过程中,目标产物对反应物的原子利用率达到100%,下列反应类型最符合这一要求的是( )
| A. | 卤代反应 | B. | 加聚反应 | C. | 酯化反应 | D. | 消去反应 |
4.某烃的结构简式为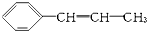 ,它可能具有的性质是( )
,它可能具有的性质是( )
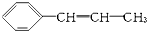 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为 | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
14.已知某镍镉(Ni-Cd)电池的电解质溶液为KOH溶液,其放电按下式进行:Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
| A. | 充电时阳极反应:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充电过程是电能转化为化学能的过程 | |
| C. | 放电时负极附近溶液的碱性不变 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
18.用下列实验装置进行相应实验,能达到实验目的是( )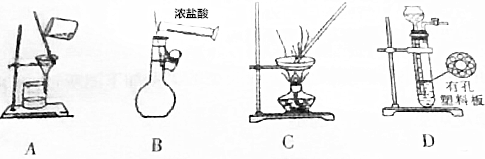

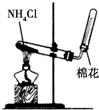
| A. | 用图a所示装置用除去淀粉溶液中的NaCl | |
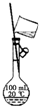
| B. | 用图b所示装置配制100mL0.100mol•L-1稀盐酸 | |
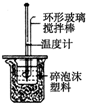
| C. | 图c所示装置可用于从碘水中分离出I2 | |
| D. | 图d所示装置可用于CaCO3和稀盐酸制取少量的CO2气体 |
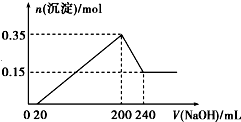
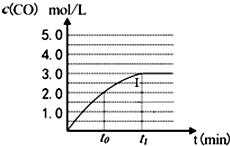 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇: