题目内容
(1)有一种叫做钾长石(K2Al2Si6O16),其化学式为写成氧化物的形式为______;
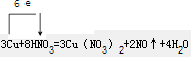
(2)反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 的离子方程式为:______;
每生成11.2L标准状况下的气体,被还原的______(填名称)的质量为______.得电子与失电子个数比是______,被氧化与被还原的原子的个数比为______,试用“单线桥”标出该反应电子转移方向和数目:______;
(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应①A+H2O→B+C ②C+F→D ③D+NaOH F+E+H2O写出A、B、C的化学式A______ B______ C______;写出反应③的离子方程式______.
F+E+H2O写出A、B、C的化学式A______ B______ C______;写出反应③的离子方程式______.
解:(1)钾长石的组成为K2Al2Si6O16,金属活泼性K>Al,利用书写顺序及原子守恒,则化学式为写成氧化物的形式为K2O?Al2O3?6SiO2,故答案为:K2O?Al2O3?6SiO2;
(2)反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 改写成离子反应时Cu、NO、H2O应保留化学式,则离子反应为3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O,生成11.2L标准状况下的气体,
NO的物质的量为0.5mol,硝酸中N元素的化合价降低,则硝酸被还原,其质量为0.5mol×63g/mol=31.5g,氧化还原反应中得失电子守恒,则得电子与失电子个数比是1:1,
Cu被氧化,硝酸被还原,由离子方程式可知,被氧化与被还原的原子的个数比为3:2,该反应Cu失去电子给N,共转移6e,则单线桥法标出该反应电子转移方向和数目为
 ,故答案为:3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O;硝酸;31.5g;1:1;3:2;
,故答案为:3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O;硝酸;31.5g;1:1;3:2; ;
;
(3)F是能使红色湿润石蕊试纸变蓝的气体,则F为氨气,A、B、C、D、E、F中都含有N元素,①A+H2O→B+C应为NO2+H2O→NO+HNO3,②C+F→D应为HNO3+NH3→NH4NO3,
③D+NaOH F+E+H2O应为NH4NO3+NaOH
F+E+H2O应为NH4NO3+NaOH NH3+NaNO3+H2O,其离子反应为NH4++OH-
NH3+NaNO3+H2O,其离子反应为NH4++OH- NH3+H2O,
NH3+H2O,
故答案为:NO2;NO;HNO3;NH4++OH- NH3+H2O.
NH3+H2O.
分析:(1)硅酸盐写成氧化物的形式是按照活泼金属的氧化物、较活泼金属的氧化物、二氧化硅、水的顺序来书写,并遵循原子守恒;
(2)单质、水、气体在化学反应改写为离子反应时应保留化学式,利用化合价来变化来分析氧化剂、还原剂及转移的电子数;
(3)F是能使红色湿润石蕊试纸变蓝的气体,则F为氨气,A、B、C、D、E、F中都含有N元素,利用转化来分析;
点评:本题为小综合,考查多个知识点,明确硅酸盐的组成、氧化还原反应中元素的化合价变化、离子方程式的书写、含氮化合物之间的转化即可解答,难度不大.
(2)反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 改写成离子反应时Cu、NO、H2O应保留化学式,则离子反应为3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O,生成11.2L标准状况下的气体,
NO的物质的量为0.5mol,硝酸中N元素的化合价降低,则硝酸被还原,其质量为0.5mol×63g/mol=31.5g,氧化还原反应中得失电子守恒,则得电子与失电子个数比是1:1,
Cu被氧化,硝酸被还原,由离子方程式可知,被氧化与被还原的原子的个数比为3:2,该反应Cu失去电子给N,共转移6e,则单线桥法标出该反应电子转移方向和数目为
 ,故答案为:3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O;硝酸;31.5g;1:1;3:2;
,故答案为:3Cu+8H++2NO3?=3Cu2++2NO↑+4H2O;硝酸;31.5g;1:1;3:2; ;
;(3)F是能使红色湿润石蕊试纸变蓝的气体,则F为氨气,A、B、C、D、E、F中都含有N元素,①A+H2O→B+C应为NO2+H2O→NO+HNO3,②C+F→D应为HNO3+NH3→NH4NO3,
③D+NaOH
 F+E+H2O应为NH4NO3+NaOH
F+E+H2O应为NH4NO3+NaOH NH3+NaNO3+H2O,其离子反应为NH4++OH-
NH3+NaNO3+H2O,其离子反应为NH4++OH- NH3+H2O,
NH3+H2O,故答案为:NO2;NO;HNO3;NH4++OH-
 NH3+H2O.
NH3+H2O.分析:(1)硅酸盐写成氧化物的形式是按照活泼金属的氧化物、较活泼金属的氧化物、二氧化硅、水的顺序来书写,并遵循原子守恒;
(2)单质、水、气体在化学反应改写为离子反应时应保留化学式,利用化合价来变化来分析氧化剂、还原剂及转移的电子数;
(3)F是能使红色湿润石蕊试纸变蓝的气体,则F为氨气,A、B、C、D、E、F中都含有N元素,利用转化来分析;
点评:本题为小综合,考查多个知识点,明确硅酸盐的组成、氧化还原反应中元素的化合价变化、离子方程式的书写、含氮化合物之间的转化即可解答,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应  (3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应
(3)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使红色湿润石蕊试纸变蓝的气体,它们之间能发生如下反应  F+E+H2O写出A、B、C的化学式A B C ;写出反应③的离子方程式 .
F+E+H2O写出A、B、C的化学式A B C ;写出反应③的离子方程式 .