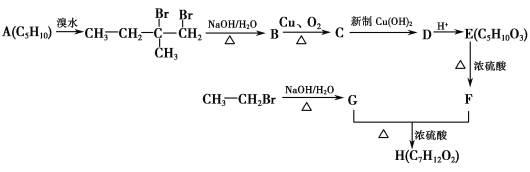
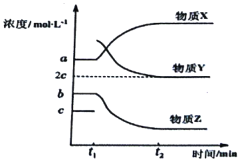
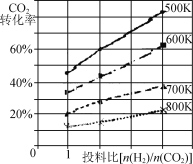
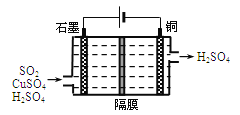
题目内容
【题目】【化学—选修3:物质结构】前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同。D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子。
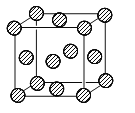
(1)E元素在周期表中的位置是 。
(2)六种元素中电负性最大的元素为 ,前五种元素中第一电离能最小的元素为______(写元素符号)。C元素与元素氟能形成C2F2分子,该分子中C原子的杂化方式是____________。
(3)配合物E(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,据此判断该分子属于 分子(填“极性”或“非极性”)。该分子中σ键与π键数目比为 。
(4)H单质的晶胞结构如图所示,则原子采取的堆积方式为 ,若已知H原子半径为r pm ,NA表示阿伏伽德罗常数,摩尔质量为M,用相应字母表示:
①该原子的配位数为 。
②该晶体的密度为 g/cm3。
③H原子采取这种堆积方式的空间利用率为 (用含π表达式表示)。
【答案】(1)第四周期第Ⅷ族 (2)O Ni sp2(3)非极性 1:1
(4)面心立方最密堆积①12 ②![]() ③
③![]() ×100%(不写也100%给分)
×100%(不写也100%给分)
【解析】
试题分析:前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,则A是H;B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同,因此B是C。D元素是地壳中含量最多的元素,所以D是O,则C是N;E为d区元素,其外围电子排布中有4对成对电子,所以E应该是Ni;H元素基态原子最外层只有一个电子,其它层均已充满电子,则F是Cu。
(1)Ni元素的原子序数是28,在周期表中的位置是第四周期第Ⅷ族。
(2)非金属性越强,电负性越大,则六种元素中电负性最大的元素为O,前五种元素中只有Ni是金属,因此第一电离能最小的元素为Ni。N元素与元素氟能形成N2F2分子,根据8电子稳定结构可知该分子的结构式为F-N=N-F,即N原子含有1对孤对电子,因此N原子的杂化方式是sp2杂化。
(3)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,由于四氯化碳和苯均是非极性分子,则根据相似相容原理可知该分子属于非极性分子。单键都是σ键,三键中含有1个σ键和2个π键,则该分子中σ键与π键数目比为8:8=1:1。
(4)H单质的晶胞结构如图所示,则原子采取的堆积方式为面心立方最密堆积,若已知H原子半径为r pm ,NA表示阿伏伽德罗常数,摩尔质量为M,用相应字母表示:
①根据晶胞结构可知该原子的配位数为12。
②晶胞中含有铜原子的个数是8×1/8+6×1/2=4,铜原子半径是rpm,则面对角线是4rpm,则晶胞的边长是![]() ,则该晶体的密度为
,则该晶体的密度为![]() =
=![]() g/cm3。
g/cm3。
③晶胞中铜原子的体积![]() ,晶胞的体积是
,晶胞的体积是![]() ,所以这种堆积方式的空间利用率为
,所以这种堆积方式的空间利用率为 =
=![]() ×100%。
×100%。

【题目】a、b、c、d、e五种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的气态氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置 ;
(2)写出一种由a、c、d所形成的离子化合物 (化学式),它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是 ;
(3)c的单质的电子式为 。
(4)b的最简单气态氢化物的结构式是
(5)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态 |
B.d的氢化物的稳定性强于b的氢化物 |
C.b与d形成的化合物中,b呈正价 |
D.d的氢化物的沸点高于b的氢化物 |