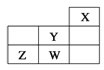
题目内容
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
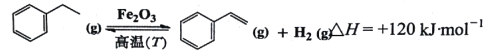
(1)升高反应温度,其转化率________,反应速率________(填“增大”、“减小”或“不变”)。
(2)等温、等压下,通入惰性气体(如水蒸气)能提高反应的转化率,其原因是________。
(3)通入水蒸气可延续催化剂Fe2O3被还原而失活,其原因是________(用化学平衡原理解释)。
(4)一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2,t2时刻再次达到平衡。回答下列问题:
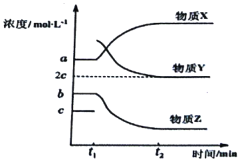
①物质X为__________,判断理由是__________;
②t2时刻,苯乙烯的浓度为______molL-1;
③t1-t2时间段内,乙苯的反应速率为_______molL-1min-1;
(5)温度T下,已知H2和苯乙烯的燃烧热△H分别为-290kJmol-1和-4400kJmol-1,则乙苯的燃烧热为△H_______kJmol-1。
【答案】(1)增大 增大 (2)体积变大,反应向分子数增加的方向进行
(3)Fe2O3在H2氛围下可生成水蒸气,加入水蒸气可促使反应左移
(4)①乙苯 加入H2后平衡向左移动,故乙苯浓度增大
②(b2+ab)/(2a+b) ③ab/[(b+2a)(t2-t1)] (5)-4570
【解析】
试题分析:(1)升高反应温度,平衡向吸热反应方向移动,该反应正向吸热,升高反应温度,平衡正向移动,乙苯转化率增大,升高反应温度任何反应速率均增大;
(2)等温、等压下,通入惰性气体,体积膨胀,相当于减小反应体系的压强,平衡向气体体积缩小的方向即正向移动,提高反应的转化率;
(3)通入水蒸气,Fe2O3在H2氛围下可生成水蒸气,加入水蒸气可促使反应左移即向生成Fe2O3的方向移动;
(4)①在t1时刻加入H2,根据图象物质X的浓度增加,则物质X为乙苯,因加入H2后平衡向左移动,故乙苯浓度增大;
②根据图象t1时刻平衡时c(乙苯)=amolL-1,c(苯乙烯)=bmolL-1,
c(氢气)=cmolL-1,则该温度下K=![]() ;
;
设t1时刻加入xmolL-1H2,则根据图象t2时刻再次达到平衡c(氢气)=2cmolL-1,则
![]()
t1(molL-1) a b c+x
转化浓度(molL-1) x-c x-c c+x-2c=x-c
t2(molL-1) a+(x-c) b-(x-c) 2c
在t1时刻加入H2,则温度不变,t2时刻再次达到平衡与原平衡平衡常数相同,则K=![]() =
=![]() ,则x=
,则x=![]() ,则t2时刻,苯乙烯的浓度为b-(x-c)=
,则t2时刻,苯乙烯的浓度为b-(x-c)=![]() molL-1;
molL-1;
③由②分析t1-t2时间段内,乙苯转化浓度为x-c=![]() molL-1,则反应速率为v=
molL-1,则反应速率为v=![]() =
=![]() molL-1;
molL-1;
(5)根据盖斯定律乙苯的燃烧热△H=-290kJmol-1 +(-4400kJmol-1)+(+120kJmol-1)=-4570kJmol-1。

 高中必刷题系列答案
高中必刷题系列答案