题目内容
某同学用废于电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验:
(1)上述三步操作中都用到的一种玻璃仪器是_____________________________。
(2)将灼烧后的固体移入试管,滴加双氧水,能迅速产生一种使带火星的木条复燃的气体,由此推断黑色固体中含有MnO2,其在反应中的作用为________,写出该反应的化学方程式_______________。MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式_____________________________________。
(3)验证步骤②的滤液中含有NH4+,下面是某一实验方案记录片断。请填写下列空白:
实验操作:_______________________________________________________________。
实验现象:有使湿润的红色石蕊试纸变蓝的气体产生。
实验结论:滤液中有NH4+存在。
(1)玻璃棒(1分)
(2)催化剂(1分) 2H2O2 2H2O+O2(2分)
2H2O+O2(2分)
MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(3)取②得适量滤液于试管中,加入氢氧化钠的浓溶液,加热,将湿润的红色石蕊试纸放在试管口观察现象。(2分)
解析试题分析:(1)溶解,过滤,灼烧都用到的玻璃仪器是玻璃棒。(2)MnO2可以作为双氧水分解的催化剂。
MnO2作氧化剂的常见反应就是实验室制氯气的反应。
考点:简单的流程图分析和图中涉及的物质的性质的考查,如MnO2的性质和铵根的检验。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO?Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ;
生成滤渣1中红褐色物质的反应离子方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是: ;
洗涤时应选用 (选填字母)。
| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |
(1)假设①:该混合金属粉末中除镁外还含有铝元素;
假设②:该混合金属粉末中除镁外还含有锌元素;
假设③: 。
●实验探究:
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设3设计另一实验方案如下:
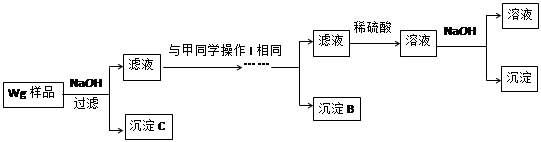
(2)试剂M是________________;沉淀B是 。
(3)丙同学认为乙同学的方案比甲同学的好,理由是 。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。
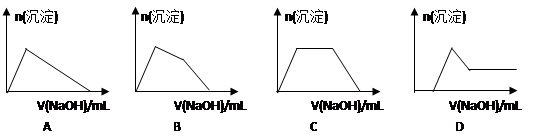
镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:
请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
| 试剂 | KOH | NaOH | Ca(OH)2 |
| 价格(元/吨) | 6800 | 3200 | 1200 |
(3)步骤3如何实现?两位同学设计下列方案:

这两种方案是否合理?请你评价:
方案一: 。
方案二: 。
你的设计方案是什么?写出流程图:
。




