题目内容
某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
该小组探究过程如下:
●查阅资料:
| ①镁、铝、锌都是银白色的金属 ②锌(Zn)可以与NaOH溶液反应生成H2 ③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O ④Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+ |
(1)假设①:该混合金属粉末中除镁外还含有铝元素;
假设②:该混合金属粉末中除镁外还含有锌元素;
假设③: 。
●实验探究:
甲同学基于假设③设计实验方案如下:

乙同学同样基于假设3设计另一实验方案如下:
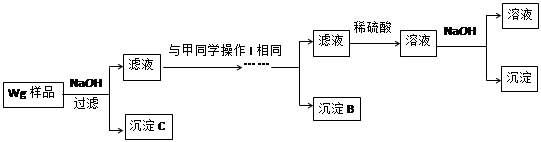
(2)试剂M是________________;沉淀B是 。
(3)丙同学认为乙同学的方案比甲同学的好,理由是 。
(4)丁同学研究了甲、乙两同学的方案后,在其中一种方案的基础上用最简便方法测定了Wg样品中金属镁(Mg)的质量,他的方法是 。
(5)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是__________。
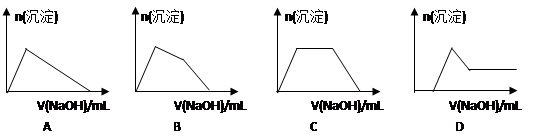
(1)该混合金属粉末中除镁外还含有铝、锌元素 (2)NaOH溶液;Al(OH)3
(3)步骤简单,节约试剂;(4)将沉淀C洗涤、小心干燥后称量;(5)稀硫酸;稀氨水;(6)B
解析试题分析:(1)由于混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,实验根据假设①②可知,假设③应该是该混合金属粉末中除镁外还含有铝、锌元素。
(2)样品与稀硫酸反应生成相应的硫酸盐。由于氢氧化锌、氢氧化铝均能和氢氧化钠溶液反应,所以首先加入过量的氢氧化钠溶液得到氢氧化镁沉淀,而锌离子和铝离子分别是生成相应的偏铝酸盐,即M是氢氧化钠溶液,沉淀A是氢氧化镁。由于Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O,但氢氧化铝不能溶于氨水中,所以可以向滤液中先加入酸将偏铝酸盐转化为锌离子和铝离子,然后加入过量的氨水得到氢氧化铝白色沉淀,而锌离子转化为[Zn(NH3)4]2+,所以沉淀B是氢氧化铝。由于Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH4+,所以向滤液中加入稀硫酸即可生成Zn2+、NH4+,最后加入适量的氢氧化钠溶液生成氢氧化锌沉淀。
(3)由于锌(Zn)、铝均可以与NaOH溶液反应生成H2,所以在乙方案中首先加入过量的氢氧化钠溶液,将锌和铝溶解,而镁不溶解,即沉淀C是镁。而后续的操作与甲方案是相同的,所以乙同学的方案比甲同学的好,理由是步骤简单,节约试剂。
(4)由于在乙方案中沉淀C就是镁,所以只需要将沉淀C洗涤、小心干燥后称量即可得出镁的含量。
(5)根据以上分析可知,操作Ⅰ的主要过程是:在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,最后再加入足量的氨水即可生成氢氧化铝白色沉淀。
(6)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则首先生成氢氧化锌、氢氧化铝沉淀。由于氢氧化锌能溶解在氨水中,所以加入的氢氧化钠首先溶解氢氧化锌,然后氢氧化钠再与溶液中的NH4+反应,最后加入的氢氧化钠再和氢氧化铝反应而使其溶解,因此生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是B。
考点:考查实验方案设计与评价;物质的分离与提纯;以及沉淀生成与溶解的图像分析与判断

趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确。
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子(提示:Ag2SO4微溶于水):
第一步:向溶液中滴加过量的 溶液,其目的是检验CO32-。并将其除去;
第二步:加入过量的Ba(NO3)2,其目的是 ;
第三步:过滤,再向滤液中加入 溶液(填化学式),发生反应的离子方程式 。
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: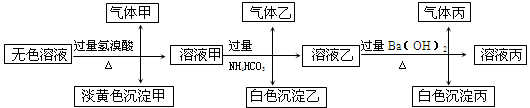
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是 。
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题。
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
(1)E、H的化学式依次为 、 。
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为 。
(3)加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuCl2·3H2O,需要经过蒸发浓缩、 、过滤、洗涤、干燥等操作,洗涤CuCl2·3H2O晶体需要的主要玻璃仪器有烧杯、 。

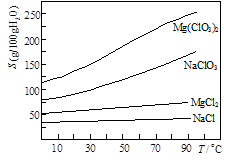
 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,

 Na2S2O3(aq)
Na2S2O3(aq)
