题目内容
已知:Fe2O3(s)+
C(s)═
CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
则:2Fe(s)+
O2(g)═Fe2O3(s)的△H是( )
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
则:2Fe(s)+
| 3 |
| 2 |
| A、-824.4 kJ/mol |
| B、-627.6 kJ/mol |
| C、-744.7 kJ/mol |
| D、-169.4 kJ/mol |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断.
解答:
解:①Fe2O3(s)+
C(s)═
CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由盖斯定律②×
-①得:2Fe(s)+
O2(g)=Fe2O3(s)△H=(-393.5kJ?mol-1)×
-234.1kJ?mol-1
即2Fe(s)+
O2(g)=Fe2O3(s)△H=-824.4kJ?mol-1.
故选A.
| 3 |
| 2 |
| 3 |
| 2 |
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由盖斯定律②×
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
即2Fe(s)+
| 3 |
| 2 |
故选A.
点评:本题考查盖斯定律的利用,难度不大,明确已知反应与目标热化学方程式的关系是关键,注意基础知识的掌握与理解.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
| A、木炭吸附NO2气体;冷却NO2气体 |
| B、打开盛装NO的集气瓶;将氯气通入品红溶液中 |
| C、用冰水混合物冷却SO3气体;加热氯化铵晶体 |
| D、向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
下列体系加压后,对化学反应速率没有明显影响的是( )
| A、2SO2+O2?2SO3 |
| B、I2(g)+H2?2HI |
| C、CO2+H2O=H2CO3 |
| D、H++OH-=H2O |
 将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示.下面说法正确的是( )
将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示.下面说法正确的是( )| A、A点的沉淀是Mg (OH)2、Al (OH)3 |
| B、B点的沉淀是Mg (OH)2、Al (OH)3 |
| C、A点时溶液中的溶质有NaCl和NaAlO2 |
| D、B点时溶液中的溶质只有NaCl和NaAlO2 |
水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-═Fe3O4+S4O62-+2H2O,下列说法中,正确的是( )
| A、Fe2+和S2O32-都是还原剂 | ||
| B、x=6 | ||
C、1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为
| ||
| D、每生成1mol Fe3O4,反应转移的电子总数为3mol |
下列反应是高温下自发进行的吸热反应的是( )
| A、NaOH+HCl=NaCl+H2O |
| B、NH4Br(s)=NH3(g)+HBr(g) |
| C、2CO+O2=CO2 |
| D、H2(s)+Cl2(g)=2HCl(g) |
某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示t0-t1阶段c(B)未画出].图乙为t2后改变互不相同的某一条件时反应速率跟时间的关系,其中t3-t4阶段使用催化剂.下列说法正确的是( )
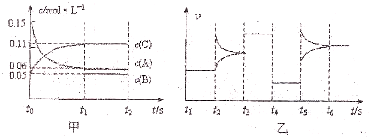

| A、若t1=15s,生成物C在t0-t1时间段的平均反应速率为0.004 mol?L-1?S-1 |
| B、t4-t5阶段改变的条件为降低反应温度 |
| C、B的起始物质的量为0.02 mol |
| D、t5-t6阶段改变的条件是增大反应物浓度 |
探究性实验:用称量法测定铁在氧气中燃烧的产物.发现5.6g铁在充足的氧气中燃烧得到7.82g固体.小芳排除其他因素可能产生的误差,则实验中得到的固体产物可能是( )
| A、Fe3O4和Fe的混合物 |
| B、Fe3O4和FeO的混合物 |
| C、Fe3O4和Fe2O3的混合物 |
| D、Fe3O4、FeO和Fe的混合物 |
分类是生活、学习和科学研究中常用的一种方法下列物质的分类正确的是( )
| A、NaOH、Na2CO3都属于碱 |
| B、HNO3、HClO都属于酸 |
| C、SO2、CO都属于酸性氧化物 |
| D、H2SO4、SO3都属于电解质 |