题目内容
10.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| B. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| C. | 58.5 g的NaCl固体中含有NA个氯化钠分子 | |
| D. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA |
分析 A.依据氮原子个数守恒解答;
B.依据n=$\frac{V}{22.4}$计算物质的量,采用极值分析判断所含氧原子数;
C.氯化钠为离子晶体,不含分子;
D.合成氨的反应为可逆反应.
解答 解:A.0.1mol NH3溶于足量水,依据氮原子个数守恒可知,溶液中N原子的数目为0.1NA,故A正确;
B.标准状况下,22.4L NO与CO2的混合气体物质的量为1mol,含有O的原子数为NA~2NA之间,故B错误;
C.氯化钠为离子晶体,不含分子,故C错误;
D.合成氨的反应为可逆反应,不能进行彻底,故充分反应后转移电子的数目小于0.6NA.故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、可逆反应的特点是解题关键,题目难度不大.

练习册系列答案
相关题目
20.已知:①I2+SO2+2H2O═2HI+H2SO4;②2FeCl2+Cl2═2FeCl3;③2FeCl3+2HI═2FeCl2|+2HCl+I2,根据上述反应,判断下列说法正确的是( )
| A. | 氧化性强弱顺序是:Fe3+>Cl2>I2>SO42- | |
| B. | 还原性强弱顺序是:SO2>I->Fe2+>Cl- | |
| C. | 反应Cl2+SO2+2H2O═2HCl+H2SO4不能发生 | |
| D. | Fe3+与I-在溶液可以大量共存 |
18.下列有关离子的检验方法和判断正确的是( )
| A. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| D. | 向某溶液中滴加NaOH溶液,除溶液体积增大外,无其它现象,说明该溶液与NaOH溶液不反应. |
5.把钠放入滴有石蕊试液的水中,下列现象不存在的是( )
| A. | 钠浮在水面上 | B. | 会听到嘶嘶声 | ||
| C. | 水溶液变为红色 | D. | 钠熔化成小球,并在水面迅速游动 |
15.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | |
| B. | x的电负性大于y的电负性 | |
| C. | x的核电荷数大于y的核电荷数 | |
| D. | x的第一电离能小于y 的第一电离能 |
2.某化学兴趣小组对二氧化碳与氢氧化钠反应后溶液中的溶质进行如下探究:向300mL 1mol/L的NaOH溶液中通入一定量CO2,充分反应后将溶液蒸发结晶,得到一定量的白色固体.
(1)该兴趣小组根据NaOH与CO2的反应,认为该白色固体的组成可能有以下几种情况:NaOH和Na2CO3、只有Na2CO3、只有NaHCO3、Na2CO3和NaHCO3.
(2)当通入标准状况下CO2的体积为2.24L时,该白色固体的组成为4 g NaOH和10.6 g Na2CO3(填写物质的化学式及对应质量).
①请设计实验方案进行实验验证.限选实验试剂:1mol•L-1 HCl溶液、1mol•L-1MgCl2溶液、0.5mol•L-1 BaCl2溶液、1mol•L-1Ba(OH)2溶液、甲基橙试液、酚酞试液.(步骤可不填满也可增加)
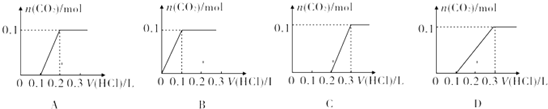
②将该白色固体配成溶液,向溶液中滴加1mol•L-1的盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C.
(1)该兴趣小组根据NaOH与CO2的反应,认为该白色固体的组成可能有以下几种情况:NaOH和Na2CO3、只有Na2CO3、只有NaHCO3、Na2CO3和NaHCO3.
(2)当通入标准状况下CO2的体积为2.24L时,该白色固体的组成为4 g NaOH和10.6 g Na2CO3(填写物质的化学式及对应质量).
①请设计实验方案进行实验验证.限选实验试剂:1mol•L-1 HCl溶液、1mol•L-1MgCl2溶液、0.5mol•L-1 BaCl2溶液、1mol•L-1Ba(OH)2溶液、甲基橙试液、酚酞试液.(步骤可不填满也可增加)
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |

19.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)⑤和⑧的元素符号是Si和Ar.
(2)表中最活泼的金属是K,非金属性最强的元素是F(填元素符号,下同)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O、Al(OH)3+KOH═KAlO2+2H2O.
(4)②、⑦、⑩三种元素的气态氢化物最稳定的是HF.
(5)写出⑤的最高价氧化物与⑨的最高价氧化物的水化物反应方程式SiO2+2KOH═K2SiO3+H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属性最强的元素是F(填元素符号,下同)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O、Al(OH)3+KOH═KAlO2+2H2O.
(4)②、⑦、⑩三种元素的气态氢化物最稳定的是HF.
(5)写出⑤的最高价氧化物与⑨的最高价氧化物的水化物反应方程式SiO2+2KOH═K2SiO3+H2O.
20.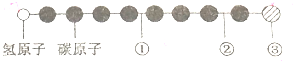 据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )
据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )
 据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )
据报道,近来发现了一种新的星际分子,其分子模型如图所示(途中给球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子).下列对该物质的说法中正确的是( )| A. | ①处的化学键表示碳碳双键 | B. | 此星际分子属于烃类 | ||
| C. | ③处的原子可能是氯原子或氟原子 | D. | ②处的化学键表示碳碳单键 |