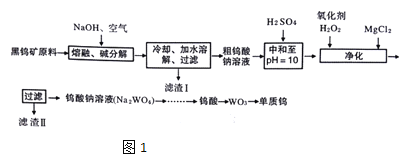
题目内容
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是![]()
![]()
A.电解精炼粗铜![]() 含有锌铁等杂质
含有锌铁等杂质![]() ,若阳极溶解32g铜,转移电子数目为
,若阳极溶解32g铜,转移电子数目为![]()
B.![]() 分子结构如图
分子结构如图![]() 含
含![]() 键数为
键数为![]()

C.某温度下,![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 数目为
数目为![]()
D.氢氧燃料电池正极消耗![]() 气体时,负极消耗的气体分子数目为
气体时,负极消耗的气体分子数目为![]()
【答案】C
【解析】
A.电解精炼铜时,粗铜![]() 含有铁、锌等杂质
含有铁、锌等杂质![]() 作阳极,根据金属的活动性顺序,阳极上锌、铁比铜先放电,后Cu放电:Cu-2e-=Cu2+,当阳极溶解
作阳极,根据金属的活动性顺序,阳极上锌、铁比铜先放电,后Cu放电:Cu-2e-=Cu2+,当阳极溶解![]() 铜时,Cu的物质的量
铜时,Cu的物质的量![]() ,Cu失去电子物质的量为1mol,阳极失去的电子数大于
,Cu失去电子物质的量为1mol,阳极失去的电子数大于![]() ,故A错误;
,故A错误;
B.根据分子结构可知,1个![]() 分子中有8个
分子中有8个![]() 键,故
键,故![]() S8的物质的量
S8的物质的量![]() ,则256g
,则256g![]() 分子中含
分子中含![]() 键数目为
键数目为![]() ,故B错误;
,故B错误;
C.根据![]() 溶液
溶液![]() 可知,
可知,![]() ,故
,故![]() 该溶液中
该溶液中![]() 数目为
数目为![]()
![]() ,故C正确;
,故C正确;
D.没有说明气体是否处于标准状况,无法计算,故D错误;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】25℃时,物质的量浓度均为0.1molL-1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)用离子方程式解释溶液⑤能去除油污的原因_____。
(2)写出溶液④中通少量CO2的离子方程式:_____。
(3)25℃时,溶液①中,由水电离产生的c(H+)=_____molL﹣1,
(4)①0.100molL-1NH4HCO3溶液中物质的量浓度最大的离子是__________(填化学式);②CH3COOH与NaOH反应后的溶液中存在:c(Na+)<c(CH3COO-),该溶液呈_________性(填“酸”“碱”或“中”),该溶液的溶质是______。(填化学式)
(5)下列说法正确的是_____。
a.c(NH4+):①>②
b.物质的量浓度和体积均相等的NaCl和NaX两种溶液中,离子总数相等
c.等体积的③和⑤形成的混合溶液中:c(HCO3-)+c(CO32-)=0.1molL-1
d.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(6)某同学欲用0.1molL-1 CaCl2溶液来鉴别溶液③和⑤,当他将CaCl2溶液滴入装有溶液③的试管中时,出现了意想不到的现象:试管中出现了白色沉淀,并伴有气体生成。试解释产生上述现象的原因:_____。