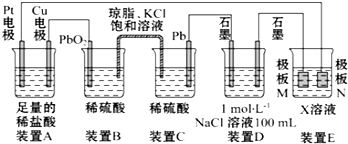
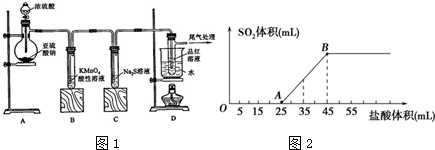
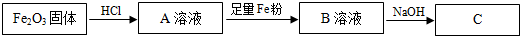题目内容
9.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 12g熔融NaHSO4中含有阳离子的总数为0.1NA | |
| B. | 0.1mol Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA | |
| D. | 合成氨反应达平衡时,每断裂3NA个氮氮三键则必生成3NA个氢氢键 |
分析 A、求出硫酸氢钠的物质的量,然后根据1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根来分析;
B、氯气和水的反应为可逆反应;
C、溶液体积不明确;
D、1mol氮气中含1mol氮氮三键.
解答 解:A、12g硫酸氢钠的物质的量为0.1mol,而1mol硫酸氢钠中含1mol钠离子和1mol硫酸氢根,故0.1mol硫酸氢钠中含0.1mol阳离子即0.1NA个,故A正确;
B、氯气和水的反应为可逆反应,故转移的电子数小于0.1NA个,故B错误;
C、溶液体积不明确,故溶液中的氢离子的个数无法计算,故C错误;
D、1mol氮气中含1mol氮氮三键,故当反应达平衡时,断裂3mol氮氮三键时即有3mol氮气参与反应,则一定生成9mol氢气即9NA个氢氢键,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
14.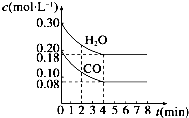 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g)CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H<0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30mol CO、0.10mol H2O、0.20mol CO2和20mol H2,则反应将向正反应方向进行 |
1.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 56g金属铁与一定量的硝酸反应时失去的电子数一定为3NA | |
| B. | 2mol SO2和1mol O2在密闭容器中加热(V2O5催化) 充分反应后,容器内分子总数为2NA | |
| C. | 1mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
19.在相同温度下,等体积、等物质的量浓度的四种溶液:①Na2SO4②H2SO3③NaHSO3④Na2S,其中所含带电粒子数由多到少的顺序是( )
| A. | ④>①>③>② | B. | ①>④>③>② | C. | ①=④>③=② | D. | ④=①>③>② |