题目内容
17.某小组用如图装置进行实验,下列说法正确的是( )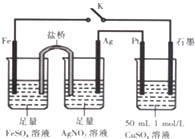
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 导线中流过0.2mol电子时,加入4.9gCu(OH)2,CuSO4溶液可恢复原组成 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 闭合K,外电路电流方向为Fe电极→石墨电极 |
分析 闭合K时,根据装置可以判断含有盐桥的为原电池装置,其中铁比银活泼为负极,银为正极,硫酸铜为电解装置,与铁相连的石墨为阴极,与银相连的为阳极,以此解答该题.
解答 解:A.由于KCl能和AgNO3产生沉淀,因此盐桥中的电解质不能用KCl,故A错误;
B.CuSO4溶液中n(Cu2+)=0.05mol,完全消耗时转移电子数为0.1mol,导线中流过0.2mol e-说明水也参与了电解,电解CuSO4的总反应2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,溶液中减少的是2Cu和O2(相当于2CuO),需要补充0.05molCuO,电解水的总反应2H2O=2H2↑+O2↑,转移电子数为0.1mol,因此消耗0.05mol的H2O,所以加入0.05mol即4.9gCu(OH)2,CuSO4溶液可恢复原组成,故B正确;
C.闭合K,与铁相连的石墨为阴极,发生还原反应首先Cu2++2e-═Cu,析出Cu,后发生2H++2e-═H2↑,放出氢气,故C错误;
D.闭合K,铁比银活泼为负极,与铁相连的石墨为阴极,所以外电路电流方向为石墨电极→Fe电极,故D错误;
故选:B.
点评 本题考查原电池、电解池的工作原理,题目难度不大,注意电极的判断和电极方程式的书写,把握原电池、电解池的工作原理,学习中注意相关知识的把握.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
7.已知0.1mol/L乙二酸溶液的pH大于1,取等体积的乙二酸溶液与NaOH溶液混合,测得溶液的pH=7,则乙二酸与NaOH物质的量浓度的比值( )
| A. | 小于$\frac{1}{2}$ | B. | 大于$\frac{1}{2}$,小于1 | C. | 等于$\frac{1}{2}$ | D. | 大于1,小于2 |
8.下列事故处理措施不正确的是( )
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 眼睛里溅进盐酸,应立即用大量水冲洗眼睛 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 在气体发生装置上直接点燃氢气时,必须先检验氢气的纯度 |
5.已知HA的酸性比HB的酸性强.现有物质的量浓度和体积均相同的NaA和NaB两种溶液,已知前者溶液中离子数目为n1,后者溶液中离子数目为n2.下列关系正确是( )
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | c(A-)<c(B-) |
9.常温下0.1mol•L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的CH3COONa固体 | ||
| C. | 加入等体积0.2 mol•L-1盐酸 | D. | 提高溶液的温度 |
6.从某NaOH溶液中取任意体积的溶液时,下列物理量一定没有发生变化的是( )
| A. | 溶液中NaOH的物质的量 | B. | 溶液中Na+的物质的量浓度 | ||
| C. | 溶液中Na+的数目 | D. | 溶液的质量 |
7.下列物质的除杂方案正确的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
| B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
| D | Cu(s) | Ag(s) | CuSO4溶液 | 电解法 |
| A. | A | B. | B | C. | C | D. | D |