题目内容
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是

A. 该反应为放热反应,v正,a<v逆,b
B. T1 K时平衡体系中可通过移走SiCl4提高SiHCl3的转化率
C. 当反应进行到a处时,v正/v逆=16/9
D. T2 K时平衡体系中再充入1 mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
【答案】BC
【解析】
A.因两曲线对应的状态只是温度不同,由图像知达到平衡所需时间T2K大于T1K,温度越高反应速率越快,所以温度T2>T1。又T2K下达到平衡时SiHCl3的物质的量分数比T1K平衡时小,说明升温平衡向正反应方向移动,由此推知该反应为吸热反应,A项错误;
B.从平衡体系中移走SiCl4,即减小生成物浓度,根据勒夏特列原理知,平衡将向正反应方向移动,反应物的转化率提高,B项正确;
C. 2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)反应前后分子数不变,即反应开始至达平衡的过程中混合气体总物质的量始终为1mol,由图像知T2K下达到平衡时SiHCl3的物质的量分数为0.75,则此时SiH2Cl2和SiCl4的物质的量分数均为0.125,因为平衡时V正=V逆,V正=k正x2(SiHCl3)=0.752k正,V逆=k逆x(SiH2Cl2)x(SiCl4)=0.1252k逆,则0.752k正=0.1252k逆,
SiH2Cl2(g)+SiCl4(g)反应前后分子数不变,即反应开始至达平衡的过程中混合气体总物质的量始终为1mol,由图像知T2K下达到平衡时SiHCl3的物质的量分数为0.75,则此时SiH2Cl2和SiCl4的物质的量分数均为0.125,因为平衡时V正=V逆,V正=k正x2(SiHCl3)=0.752k正,V逆=k逆x(SiH2Cl2)x(SiCl4)=0.1252k逆,则0.752k正=0.1252k逆,![]() =
=![]() =
=![]() ,因k正和k逆只与温度有关,反应进行到a点处时V正= k正x2(SiHCl3)=0.82k正,V逆= k逆x(SiH2Cl2)x(SiCl4)=0.12k逆。
,因k正和k逆只与温度有关,反应进行到a点处时V正= k正x2(SiHCl3)=0.82k正,V逆= k逆x(SiH2Cl2)x(SiCl4)=0.12k逆。![]() =
=![]() ×
×![]() =
=![]() ×
×![]() =
=![]() 。C项正确;
。C项正确;
D.恒容条件下再充入1molSiHCl3,相当于增大压强,而2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)反应前后气体体积不变,所以平衡不移动,x(SiH2Cl2)不变,D项错误;答案选BC。
SiH2Cl2(g)+SiCl4(g)反应前后气体体积不变,所以平衡不移动,x(SiH2Cl2)不变,D项错误;答案选BC。

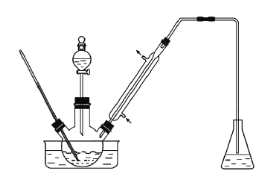
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1) 实验装置中冷凝管的主要作用是___________________。
(2) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为__________________
(3) 写出由苯甲醛制取间溴苯甲醛的化学方程式_____________________________________________________
(4) 为防止污染环境,锥形瓶中盛装的溶液应该是______________________________




