题目内容
把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g).2min时生成0.3mol W,此时测知以Z的浓度变化表示的反应速率为0.05mol?L-1?min-1.
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为 mol?L-1?min-1.
(2)计算n值和2min末时Y的浓度(写出必要的计算过程).
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为
(2)计算n值和2min末时Y的浓度(写出必要的计算过程).
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据v=
,及方程式利用三段式进行解答,得出正确结论.
| △c |
| t |
解答:
解:4X(g)+5Y(g)═nZ(g)+6W(g)
起始量/mol 0.4 0.6 0 0
转化量/mol 0.2 0.25 0.05n 0.3
2 min末/mol 0.2 0.35 0.05n 0.3
(1)v(X)=
=
=0.05mol?L-1?min-1,
故答案为:0.05mol?L-1?min-1;
(2)v(Z)=
=
=0.05mol?L-1?min-1
解得n=4,
2min末时Y的浓度为
=0.175 mol?L-1,
答:n=4;2min末时Y的浓度为0.175 mol?L-1.
起始量/mol 0.4 0.6 0 0
转化量/mol 0.2 0.25 0.05n 0.3
2 min末/mol 0.2 0.35 0.05n 0.3
(1)v(X)=
| △c |
| t |
| ||
| 2 |
故答案为:0.05mol?L-1?min-1;
(2)v(Z)=
| △c |
| t |
| ||
| 2 |
解得n=4,
2min末时Y的浓度为
| 0.35 |
| 2 |
答:n=4;2min末时Y的浓度为0.175 mol?L-1.
点评:本题考查化学反应速率的相关计算,难度不大.把握三段式进行解答是解题的关键.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
下列有关实验的做法不正确的是( )
| A、分液操作时分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、容量瓶使用前需要检查是否漏水 |
| C、配置0.1000mol?L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
将淀粉-KI混合液装在半透膜中,浸泡在盛蒸馏水的烧杯中一段时间后,某学生取烧杯中液体滴加几滴试剂便立即报告老师说:这个半透膜袋已经破损了,老师肯定了他的做法.这位学生所滴的试剂及观察到的现象是( )
| A、滴两滴碘水显蓝色 |
| B、滴淀粉试液显蓝色 |
| C、滴入氯水一淀粉试液显蓝色 |
| D、滴AgNO3,溶液出现黄色沉淀 |
 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示.
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示. 分子中n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系.
分子中n1=6、n2=1、n3=2、n4=1.试根据不同烷烃的组成结构,分析出烷烃(除甲烷外)各原子数的关系.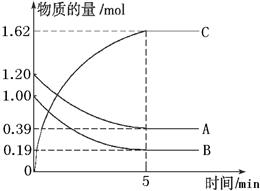 一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示.根据图象进行计算:
一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示.根据图象进行计算: