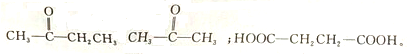题目内容
铜,镓(Ga),硒(Se),硅等元素的化合物是生产第三代太阳能电池的重要材料.
(1)硒(Se)位于元素周期表第 周期第 族,Si的基态原子核外有 个未成对电子,已知高温下CuO→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应放生的原因 ;
(2)硒,硅均能与氢元素形成气态氢化物,若“Si-H”中键合电子偏向氢原子,氢气与硒反应时单质硒是氧化物,则硒与硅的电负性相对大小为 .硒酸的氧化性很强,可氧化浓盐酸,写出硒酸与浓盐酸的反应方程式 ;
已知GaCL3的熔点为78℃,沸点201.3℃,GaF3的熔点为950℃,沸点为1000℃,则GaF3中化学键类型为 .
GaCl3的晶体中结构粒子间的作用力是 ;
(3)铝和镓的性质相似,如Ga(OH)3也是难容的两性氢氧化物,请写出其在水中的电离方程式 .
(1)硒(Se)位于元素周期表第
(2)硒,硅均能与氢元素形成气态氢化物,若“Si-H”中键合电子偏向氢原子,氢气与硒反应时单质硒是氧化物,则硒与硅的电负性相对大小为
已知GaCL3的熔点为78℃,沸点201.3℃,GaF3的熔点为950℃,沸点为1000℃,则GaF3中化学键类型为
GaCl3的晶体中结构粒子间的作用力是
(3)铝和镓的性质相似,如Ga(OH)3也是难容的两性氢氧化物,请写出其在水中的电离方程式
考点:常见金属元素的单质及其化合物的综合应用,元素周期表的结构及其应用,元素周期律的作用
专题:
分析:(1)硒(Se)为34号元素,位于周期表中第四周期第ⅥA族,Si为14号元素,它的基态原子核外最外层有4个电子,p轨道上有2个都未成对,Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,据此答题;
(2)若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价;硒酸的氧化性很强,可氧化浓盐酸,得到氯气,根据电子守恒和元素守恒写化学方程式,根据题中信息,GaCl3的熔点较低,GaF3的熔点为较高,所以aCl3为分子晶体,GaF3为离子晶体,据此答题;
(3)铝和镓的性质相似,如Ga(OH)3也是难容的两性氢氧化物,根据氢氧化铝的性质可写出其在水中的电离方程式;
(2)若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价;硒酸的氧化性很强,可氧化浓盐酸,得到氯气,根据电子守恒和元素守恒写化学方程式,根据题中信息,GaCl3的熔点较低,GaF3的熔点为较高,所以aCl3为分子晶体,GaF3为离子晶体,据此答题;
(3)铝和镓的性质相似,如Ga(OH)3也是难容的两性氢氧化物,根据氢氧化铝的性质可写出其在水中的电离方程式;
解答:
解:(1)硒(Se)为34号元素,位于周期表中第四周期第ⅥA族,Si为14号元素,它的基态原子核外最外层有4个电子,p轨道上有2个都未成对,Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+,
故答案为:四,ⅥA;2;Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+;
(2)若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si;硒酸的氧化性很强,可氧化浓盐酸,得到氯气,反应的化学方程式为H2SeO4+2HCl=SeO2+Cl2↑+2H2O,根据题中信息,GaCl3的熔点较低,GaF3的熔点为较高,所以aCl3为分子晶体,GaF3为离子晶体,GaF3中化学键类型为离子键,GaCl3的晶体中结构粒子间的作用力是分子间作用力,
故答案为:Se>Si;H2SeO4+2HCl=SeO2+Cl2↑+2H2O;离子键;分子间作用力;
(3)铝和镓的性质相似,如Ga(OH)3也是难容的两性氢氧化物,其在水中的电离即可以是酸式电离又可以是碱式电离,电离方程式为3OH-+Ga3+?Ga(OH)3?GaO2-+H2O+H+,
故答案为:3OH-+Ga3+?Ga(OH)3?GaO2-+H2O+H+;
故答案为:四,ⅥA;2;Cu2+的价电子结构为3d9,Cu+的价电子结构为3d10,3d10为稳定结构,所以在高温时,Cu2+得一个电子变成稳定结构的Cu+;
(2)若“Si-H”中键合电子偏向氢原子,说明硅显正价,氢气与硒反应时单质硒是氧化剂,硒显负价,所以硒与硅的电负性相对大小为Se>Si;硒酸的氧化性很强,可氧化浓盐酸,得到氯气,反应的化学方程式为H2SeO4+2HCl=SeO2+Cl2↑+2H2O,根据题中信息,GaCl3的熔点较低,GaF3的熔点为较高,所以aCl3为分子晶体,GaF3为离子晶体,GaF3中化学键类型为离子键,GaCl3的晶体中结构粒子间的作用力是分子间作用力,
故答案为:Se>Si;H2SeO4+2HCl=SeO2+Cl2↑+2H2O;离子键;分子间作用力;
(3)铝和镓的性质相似,如Ga(OH)3也是难容的两性氢氧化物,其在水中的电离即可以是酸式电离又可以是碱式电离,电离方程式为3OH-+Ga3+?Ga(OH)3?GaO2-+H2O+H+,
故答案为:3OH-+Ga3+?Ga(OH)3?GaO2-+H2O+H+;
点评:本题考查结构性质位置关系的应用,主要考查了元素周期表、离子核外电子排布、电负性、化学键及分子间作用力、及元素的性质等知识,难度不大,答题时注意元素周期律和元素化合物知识的灵活运用.

练习册系列答案
相关题目
如图a为在恒温恒容密闭容器中分别充入X、Y、Z三种气体,一定条件下发生反应各物质浓度随时间的变化.若从t2开始,每个时刻只改变一个且不同的条件,物质Z的正、逆反应速率随时间变化如图b.下列分析不正确的是( )

A、0-t1时,v(Y)=
| ||
| B、t2时刻改变的条件可能是压强或催化剂 | ||
| C、该反应的正反应为放热反应 | ||
| D、该反应中Z一定为产物 |
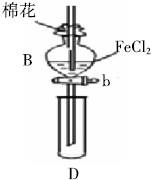 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
 的物质,该物质是一种香料.
的物质,该物质是一种香料.

 原子的最外层电子数相差1.请回答下列问题:
原子的最外层电子数相差1.请回答下列问题: 则
则 发生羟醛缩合反应的产物不可能是( )
发生羟醛缩合反应的产物不可能是( )