题目内容
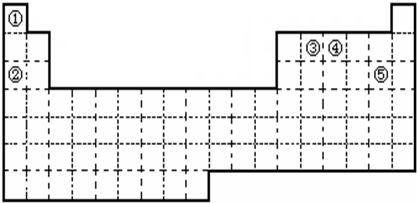
 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.(1)可用于半导体材料的元素是
(2)第3周期IA族元素的原子结构示意图是
(3)第3周期元素的最高价氧化物对应水化物中,酸性最强的是
(4)由H、N、O三种元素组成的离子化合物X,在 210℃时可分解生成N元素的一种气态氧化物Y和水.已知 40g X完全分解可生成11.2L(标准状况)Y,则Y的化学式为
分析:(1)Si位于金属与非金属性的交界处,在周期表中的第三周期第ⅣA族;
(2)第3周期IA族元素为Na,原子序数为11,同周期ⅤⅡA族元素为Cl,二者形成NaCl,为离子化合物;
(3)第3周期元素中,Cl的非金属性最强,Na的金属性最强,Al的氢氧化物具有两性,与NaOH反应生成偏铝酸钠和水;
(4)由H、N、O三种元素组成的离子化合物X为NH4NO3,n(X)=
=0.5mol,生成11.2L(标准状况)Y,n(Y)=
=0.5mol,由N原子守恒分析.
(2)第3周期IA族元素为Na,原子序数为11,同周期ⅤⅡA族元素为Cl,二者形成NaCl,为离子化合物;
(3)第3周期元素中,Cl的非金属性最强,Na的金属性最强,Al的氢氧化物具有两性,与NaOH反应生成偏铝酸钠和水;
(4)由H、N、O三种元素组成的离子化合物X为NH4NO3,n(X)=
| 40g |
| 80g/mol |
| 11.2L |
| 22.4L/mol |
解答:解:(1)Si位于金属与非金属性的交界处,可用于半导体材料,Si原子结构中有3个电子层,最外层电子数为4,则在周期表中的第三周期第ⅣA族,
故答案为:Si;第三周期第ⅣA族;
(2)第3周期IA族元素为Na,原子序数为11,其原子结构示意图为 ,同周期ⅤⅡA族元素为Cl,二者形成NaCl,以离子键结合,为离子化合物,NaCl为工业生产中氯碱工业的原料,生活中的调味品,故答案为:
,同周期ⅤⅡA族元素为Cl,二者形成NaCl,以离子键结合,为离子化合物,NaCl为工业生产中氯碱工业的原料,生活中的调味品,故答案为: ;离子化合物;氯碱工业的原料(或生活中的调味品);
;离子化合物;氯碱工业的原料(或生活中的调味品);
(3)第3周期元素中,Cl的非金属性最强,则最高价氧化物对应水化物中,酸性最强的是HClO4,Na的金属性最强,碱性最强为NaOH,Al的氢氧化物Al(OH)3具有两性,与NaOH反应生成偏铝酸钠和水,离子反应为Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:HClO4;NaOH;Al(OH)3;Al(OH)3+NaOH=NaAlO2+2H2O;
(4)由H、N、O三种元素组成的离子化合物X为NH4NO3,n(X)=
=0.5mol,生成11.2L(标准状况)Y,n(Y)=
=0.5mol,反应中-3价N元素化合价升高,+5价N元素化合价降低,由N原子守恒可知,Y中含2个N原子,则氧化物应为N2O,故答案为:N2O.
故答案为:Si;第三周期第ⅣA族;
(2)第3周期IA族元素为Na,原子序数为11,其原子结构示意图为
 ,同周期ⅤⅡA族元素为Cl,二者形成NaCl,以离子键结合,为离子化合物,NaCl为工业生产中氯碱工业的原料,生活中的调味品,故答案为:
,同周期ⅤⅡA族元素为Cl,二者形成NaCl,以离子键结合,为离子化合物,NaCl为工业生产中氯碱工业的原料,生活中的调味品,故答案为: ;离子化合物;氯碱工业的原料(或生活中的调味品);
;离子化合物;氯碱工业的原料(或生活中的调味品);(3)第3周期元素中,Cl的非金属性最强,则最高价氧化物对应水化物中,酸性最强的是HClO4,Na的金属性最强,碱性最强为NaOH,Al的氢氧化物Al(OH)3具有两性,与NaOH反应生成偏铝酸钠和水,离子反应为Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:HClO4;NaOH;Al(OH)3;Al(OH)3+NaOH=NaAlO2+2H2O;
(4)由H、N、O三种元素组成的离子化合物X为NH4NO3,n(X)=
| 40g |
| 80g/mol |
| 11.2L |
| 22.4L/mol |
点评:本题考查位置、结构、性质的关系及应用,明确元素的位置与性质的关系是解答的关键,熟悉元素及化合物的性质即可解答,题目难度不大,(4)为解答的难点.

练习册系列答案
相关题目